1、选择题 甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们。根据下图中的转化关系,下列判断错误的是(?)

A.甲是BaCl2
B.丙是Ba(NO3)2
C.戊是Na2SO4
D.X是Na2CO3
参考答案:C
本题解析:考查物质的鉴别、离子反应的内容。本题的突破点是“气体B”一定是CO2,戊为NaOH,生成的X为Na2CO3;进而可知白色沉淀A为BaCO3,乙为硝酸,丙为硝酸钡;甲必然为BaCl2;那么丁必然为Na2SO4,与丙生成白色沉淀C:BaSO4
故答案为C
本题难度:一般
2、选择题
(1)写出元素的名称:A?,C?。
(2)Y分子是?分子(填极性和非极性)。
(3)写出实现下列转化的化学反应方程式并标明电子转移的方向和数目:
C2+(BA)n→A2?
(4)B4A3D2水溶液呈酸性,写出其呈酸性的离子方程式:?
参考答案:(7分)(1)氧,氯(每格1分)(2)极性分子(1分)
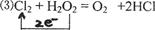 (2分,未标电子转移方向和数目,扣1分。)? (4)
(2分,未标电子转移方向和数目,扣1分。)? (4) (2分)
(2分)
本题解析:据题意,A、B、C、D四种元素,由A、B可形成两种液态化合物,其最简式分别为BA和B2A。可推知A、B可能是H和O;由B与D可形成一种极易溶于水的碱性气体X,中学阶段碱性气体只有氨气,可知B、D可能是N、H;由此:A是O,B是H,D是N;由B与C可形成极易溶于水的酸性气体Y,极易溶于水的气体常见的有氨气、氯化氢、溴化氢等,由Y分子与最简式为BA的分子中的电子数相等,可知应该是氯化氢。即C是Cl。此题可解。
本题难度:一般
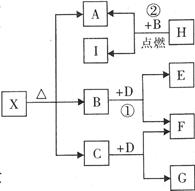
3、填空题 由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示(某产物已略去):
已知:B、X为单质,常温下D为无色液体,A、B含同一种元素。
请回答下列问题:
(1)若E气体是大气污染物,F是一元强酸。
①写出E→F反应的化学方程式:?。
②现有25℃时0.1 mol·L-1 A的水溶液,若向其中加入等体积0.1 mol·L-1的稀硫酸,则所得溶液中各离子的物质的量浓度由大到小的顺序是?。
③在常温下,向V1 L pH=a的A的水溶液中加入V2 L pH=b的盐酸,且a+b=14,若恰好完全反应,则V1和V2的关系为Vl?V2(填“>”、“<”、“=”或“无法确定”),等pH的所得溶液与盐酸比较,由水电离出的c(H+)前者为后者的108倍,则两种溶液的pH=?。
(2)若E气体不是大气污染物,F是二元弱酸。
①B所含元素在周期表中的位置?。
②写出氧化铁与C反应的化学方程式:?;将少量气体E通入氢氧化钙溶液中得不溶物F,F的Ksp=2.8×10-9。现将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp?(填“增大”、“减小”或“不变”),此时,组成不溶物F的阴离子在溶液中的浓度为?。
参考答案:(1)① 3NO2+H2O=2HNO3+NO ?②c(H+)> c( SO42-) > c(NH4+) >c(OH-)?③ <? 3
(2)①第二周期ⅣA族?② Fe2O3+3CO 2 Fe +3CO2?不变?2.8×10-8 mol·L-1
2 Fe +3CO2?不变?2.8×10-8 mol·L-1
本题解析:(1)根据物质间的相互转化关系及已知条件可推知A是NH3,B是N2,C是NO,D是H2O,E是NO2。F是HNO3,X是O2。①写出E→F反应的化学方程式是3NO2+H2O=2HNO3+NO;②氨水与硫酸等体积等浓度混合得到的为NH4HSO4溶液。NH4HSO4= NH4++H++SO42-。由于发生:NH4++H2O  NH3·H2O+H+。H2O
NH3·H2O+H+。H2O OH-+H+。所以所得溶液中各离子的物质的量浓度由大到小的顺序是c(H+)> c( SO42-) > c(NH4+) >c(OH-)。③在常温下,对于NH3·H2O pH=a,C(H+)= 10-amol/L ,C(OH-)= 10(a-14)mol/L pH=b的盐酸,C(H+)=10-bmol/L 且a+b=14,所以C(H+)= C(OH-)。由于碱为弱碱C(NH3·H2O)>C(HCl).若恰好完全反应, V1和V2的关系是V1<V2。若NH4Cl与HCl的PH相等,假设它们的PH为X,则前者水电离产生的C(H+)=10-amol/L,后者由水电离出的c(H+)为10-(a+8)mol/L, C(OH-)= c(H+)=10-(a+8)mol/L,在整个溶液中C(OH-)·c(H+)=Kw=10-14. 10-(a+8) ·10-a=10-14.解得a="3." 则两种溶液的pH=3.(2) 根据物质间的相互转化关系及已知条件可推知A是CH4,B是C,C是CO,D是H2O,E是CO2。F是H2CO3,X是O2。①B所含元素在周期表中的位置第二周期ⅣA族,②写出氧化铁与CO反应的化学方程式:Fe2O3+3CO
OH-+H+。所以所得溶液中各离子的物质的量浓度由大到小的顺序是c(H+)> c( SO42-) > c(NH4+) >c(OH-)。③在常温下,对于NH3·H2O pH=a,C(H+)= 10-amol/L ,C(OH-)= 10(a-14)mol/L pH=b的盐酸,C(H+)=10-bmol/L 且a+b=14,所以C(H+)= C(OH-)。由于碱为弱碱C(NH3·H2O)>C(HCl).若恰好完全反应, V1和V2的关系是V1<V2。若NH4Cl与HCl的PH相等,假设它们的PH为X,则前者水电离产生的C(H+)=10-amol/L,后者由水电离出的c(H+)为10-(a+8)mol/L, C(OH-)= c(H+)=10-(a+8)mol/L,在整个溶液中C(OH-)·c(H+)=Kw=10-14. 10-(a+8) ·10-a=10-14.解得a="3." 则两种溶液的pH=3.(2) 根据物质间的相互转化关系及已知条件可推知A是CH4,B是C,C是CO,D是H2O,E是CO2。F是H2CO3,X是O2。①B所含元素在周期表中的位置第二周期ⅣA族,②写出氧化铁与CO反应的化学方程式:Fe2O3+3CO 2 Fe +3CO2。因为沉淀的溶度积常数KSp只与温度有关,与离子的浓度大小无关,所以将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp不变。此时,组成不溶物F的阴离子在溶液中的浓度为2.8×10-9÷0.1=2.8×10-8 mol/L.
2 Fe +3CO2。因为沉淀的溶度积常数KSp只与温度有关,与离子的浓度大小无关,所以将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp不变。此时,组成不溶物F的阴离子在溶液中的浓度为2.8×10-9÷0.1=2.8×10-8 mol/L.
本题难度:困难
4、填空题 欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
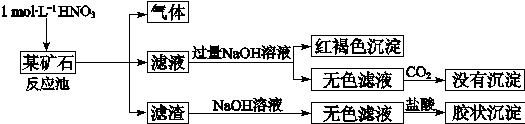
(1)Si在周期表中的位置是?。
(2)下列说法正确的是?。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是?,滤渣和NaOH溶液反应的离子方程式是?。
(4)该矿石和1 mol?L-1HNO3反应的离子方程式?。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是?;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol?L-1 HNO3的体积为?L。
参考答案:(1)第三周期、Ⅳ族?(2)abc
(3)FeCO3和SiO2? SiO2+2OH?=SiO32?+H2O
(4)3FeCO3+10H++NO3?=3Fe3++3CO2↑+NO↑+5H2O
(5)NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸,提高原料利用率;3×104。
本题解析:(1)Si为14号元素,位于周期表第三周期、Ⅳ族 。
(2)碳元素的非金属性强于硅元素,则碳酸的酸性强于硅酸,a正确;根据原子半径变化规律可知,原子半径:O<C<Si<Al,b正确;非金属性越强,氢化物的稳定性越强,c正确;核外电子排布相同的微粒,微粒半径随原子序数的增大而减小,离子半径应该是O2->Al3+,则d不正确,故答案为abc。
(3)根据流程图,加入HNO3产生气体,加过量NaOH溶液产生红褐色沉淀,说明矿石含FeCO3,;无色滤液通入CO2,没有沉淀生成,说明矿石不含Al2O3,;滤渣加入NaOH溶液得到无色滤液,加盐酸生成胶状沉淀,说明矿石含SiO2,所以该矿石的组成是:FeCO3和SiO2;SiO2为酸性氧化物,与NaOH溶液反应的离子方程式为:SiO2+2OH?=SiO32?+H2O。
(4)矿石中的碳酸亚铁被硝酸氧化,所以反应的离子方程式是3FeCO3+10H++NO3-?=3Fe3++3CO2↑+NO↑+5H2O。
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸,提高原料利用率。根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103?kg-1.2×103?kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是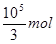 ,所以理论上至少需要1 mol?L-1?HNO3的体积为3.33×104 L。
,所以理论上至少需要1 mol?L-1?HNO3的体积为3.33×104 L。
本题难度:一般
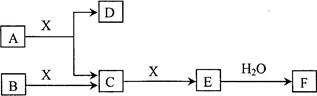
5、选择题 有一化合物X,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
?
⑴X中滴入少量NaOH溶液的离子方程式为_______________________。
⑵B和D反应生成F的化学方程式为_____________________________。
⑶I转化为G的反应中,当有2 molG生成时,转移的电子数为_______。
⑷引发H和W反应的操作是____________________________________。
参考答案:⑴Fe2++2OH- Fe(OH)2↓(2分)
Fe(OH)2↓(2分)
⑵4NH3+5O2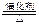 4NO+6H2O(2分)⑶2NA(2分)
4NO+6H2O(2分)⑶2NA(2分)
⑷在混合物的上方铺上少量KClO3,插上镁条并点燃(2分)
本题解析:根据C为难溶于水的红褐色固体可得C为Fe(OH)3,A为Fe(OH)2,X中含有Fe2+,H为Fe2O3,根据W是常见金属,且H和W反应能放出大量的热可判断该反应为铝热反应。根据B、D、F均为气体,且B和D反应后的产物F又能和D发生反应,可推知该过程是连续氧化的过程,D是O2,气体B是X溶液中加碱后的产物,结合前面分析可推知B是NH3。
本题难度:一般