1、选择题 设NA为阿伏加德罗常数的值,下列说法正确的是?
A.2.3g金属钠变为钠离子时失电子数为0.1NA
B.1molOH- 中含有的电子数为10NA
C.在常温下22.4L氢气所含有的原子数目为NA
D.100mL0.1mol/L稀硫酸中含有硫酸根的个数为0.1NA
参考答案:AB
本题解析:略
本题难度:简单
2、选择题 NA代表阿伏加德罗常数的值,下列说法正确的是
A.在2升2mol/L的(NH4)2SO4溶液中所含的NH4 +的数目是8NA
B.常温常压下,1molCaC2晶体中含有的阴离子数为 2NA
C.在Cu与S的反应中,1molCu失去的电子数为NA
D.标准状况下,22.4L三氧化硫中含有NA个三氧化硫分子
参考答案:C
本题解析:
正确答案:C
A. 不正确,NH4 +有部分水解,NH4+ 的数目少于8NA
B. 不正确,常温常压下,1molCaC2晶体中含有的阴离子数为 Na,C22―是原子团
C.正确, 2Cu+S=Cu2S反应中,1molCu失去的电子数为NA
D.不正确,标准状况下,三氧化硫是固体。
本题难度:简单
3、选择题 若阿伏加德罗常数的数值为NA,则下列说法中正确的是
A.1.0L0.1 mol·L-1Na2S溶液中含有的S2-离子数小于0.1NA
B.1 molFe与过量的氯气反应,转移电子的数目为2 NA
C.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
D.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
参考答案:A
本题解析:n(Na2S)=0.1mol·L-1×1.0L=0.1mol,Na2S =2Na++ S2-,n(S2-)= n(Na2S)=0.1mol,但是Na2S是强碱弱酸盐,S2-能水解,则溶液中n(S2-)<0.1mol,故A正确;根据氯气的性质可知,2Fe+3Cl2=2FeCl3~6e-,根据系数之比等于物质的量之比可知,1mol铁与过量氯气反应转移3mol电子,故B错误;缺少标准状况下,气体摩尔体积不一定等于22.4L/mol,则混合气体不一定为0.1mol,所含碳原子不一定为0.1mol,故C错误;n(H2SO4)="18.4" mol·L-1×0.05L=0.92mol,Cu+2H2SO4(浓)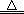 CuSO4+SO2↑+2H2O,但是生成的n(SO2)一定小于0.46mol,因为铜足量,浓硫酸变为稀硫酸,所以参加上述反应的n(H2SO4)一定小于0.92mol,故D正确。
CuSO4+SO2↑+2H2O,但是生成的n(SO2)一定小于0.46mol,因为铜足量,浓硫酸变为稀硫酸,所以参加上述反应的n(H2SO4)一定小于0.92mol,故D正确。
本题难度:简单
4、选择题 下列有关化学研究的说法正确的是
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.化学家提出的假设都能被实验证实
D.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律
参考答案:C
本题解析:A、每次只能改变一个变量,进行研究;
B、盖斯定律表述为“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)”
C、研究过程是这样的;
D、非金属性与酸性的关系式指最高价氧化物对应水化物的酸性。
本题难度:一般
5、选择题 NA表示阿佛加德罗常数,下列说法正确的是
A.常温常压下,0.1molC8H18所含有的共价键数目为2.5NA
B.0.1mol过氧化钠固体中含有的阴离子数为0.2NA
C.标准状况下2.24L三氧化硫中所含氧原子数为0.3NA
D.0.1mol氯气与热的氢氧化钠溶液反应时转移电子数为0.1NA
参考答案:A
本题解析:A项,0.1molC8H18中含有2.5mol共价键,即2.5NA,对
B项,1mol过氧化钠由2molNa+和1molO2-构成,故0.1mol过氧化钠固体中含有的阴离子数为0.1NA,错
C项标况下,三氧化硫为固体,错
D项氯气与热的氢氧化钠溶液反:Cl2+6NaOH=5NaCl+NaClO3+3H2O,转移的电子数为0.5NA
点评:阿伏伽德罗常数是高中化学的常考点,1mol气体在标况下的体积才为22.4L,一是气体,二是标况,两者缺一不可,此为常考考点,考生应注意。
本题难度:简单