1、填空题 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示
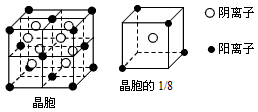
(1)A和E所形成的化合物的电子式是______________
(2)A、B、C、D四种元素的原子半径由小到大的顺序为_____________(用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是__________________
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有______个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为
___________(结果保留一位小数)
参考答案:(1)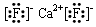 ?
?
(2)F < Cl < Al < Na
(3)由于HF分子间存在氢键
(4)12
(5)3.2g/cm3
本题解析:
本题难度:一般
2、选择题 下列物质发生变化时,所克服的粒子间相互作用属同中类型的是
A.金属钠与固态水分别受热熔化
B.氯化铵与苯分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
参考答案:D.
本题解析:碘和干冰都是分子晶体
本题难度:简单
3、填空题 硫化氢(H2S)分子中,两个H-S键的夹角接近90°,说明H2S分子的空间构型为_____________ ;二氧化碳(CO2)分子中,两个C=O键的夹角接近180°,说明CO2分子的空间构型为____________ ;甲烷(CH4)分子中,四个H-C键的夹角接近109°28′,说明CH4分子的空间构型为______________ 。
参考答案:V形;直线形;正四面体
本题解析:
本题难度:一般
4、选择题 下列晶体中,熔点最高的是(?)
A.KF
B.MgO
C.CaO
D.NaCl
参考答案:B
本题解析:四种物质形成的晶体均是离子晶体,离子晶体中离子键越强,物质的熔点越高,形成离子键的离子的离子半径越小,所带电荷数越多,离子键越强,熔点越高。阴离子比较大小顺序为O2->F->Cl-,阳离子大小顺序为K+>Ca2+>Na+>Mg2+,所以答案是B。
本题难度:一般
5、选择题 下列晶体熔化时,晶体中的化学键未被破坏的是(?)
A.金属镁
B.氯化钠晶体
C.冰
D.晶体硅
参考答案:C
本题解析:略
本题难度:简单