1、选择题 下列物质的熔点由高到低排列的顺序为(?)


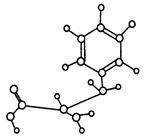
①NaCl?②金刚石?③CO2?④晶体硅?⑤CS2
A.②①⑤④③
B.②④①③⑤
C.②④①⑤③
D.④②①⑤③
参考答案:C
本题解析:略
本题难度:简单
2、选择题 下列叙述中,错误的是(?)
A.离子化合物中可能含有非极性键
B.分子晶体中不含离子键
C.原子晶体中可能含有非极性键
D.分子晶体中一定有共价键
参考答案:D
本题解析:略
本题难度:简单
3、选择题 共价键、离子键和范德华力都是粒子之间的不同作用力,下列物质同时含有上述两种作用力的组合是( )?
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷?
A.①②④
B.①③⑥
C.②④⑥
D.③④⑤?
参考答案:B?
本题解析:Na2O2中Na+与O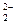 之间以离子键结合,O
之间以离子键结合,O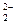 中O—O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以分子间作用力结合,符合条件;白磷(P4)分子内P—P以共价键结合,而P4分子之间以分子间力结合,也符合题意;SiO2、金刚石只有共价键,为原子晶体,NaCl中只有离子键。?
中O—O以共价键结合,符合条件;石墨中每一层内以碳碳键结合,层与层之间以分子间作用力结合,符合条件;白磷(P4)分子内P—P以共价键结合,而P4分子之间以分子间力结合,也符合题意;SiO2、金刚石只有共价键,为原子晶体,NaCl中只有离子键。?
本题难度:一般
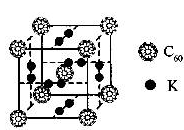
4、填空题 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。
(1)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为?
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为?
(3)写试出C60、Si60、N60熔点由高到低的顺序为?,破坏这三种分子所需要的能量顺序为??
参考答案:(1)3:1? (2)30? (3) Si60>N60> C60、?N60>C60>Si60
本题解析:(1)根据晶胞可知,K原子的个数是6×1/2=3个,而C60分子的个数8×1/8=1个,所以该物质的K原子和C60分子的个数比为3:1。
(2)根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构。显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30。
(3) C60、Si60、N60形成的晶体都是分子晶体,熔点高低和相对分子质量大小有关系,所以熔点高到低的顺序为Si60>N60> C60。破坏这三种分子需要破坏共价键,所以所需要的能量顺序为N60>C60>Si60。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
5、填空题 最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是____________。
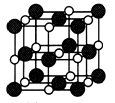
参考答案:TiC
本题解析:
本题难度:一般