1、选择题 设NA为阿伏加德罗常数的值,下列有关叙述正确的是?(?)
A.28g乙烯所含共用电子对数目为4NA
B.0.5 mol 1, 3-丁二烯分子中含有C=C双键数为 NA
C.1 mol羟基所含的电子总数为10NA
D.标准状况下,11.2 L己烷所含分子数为0.5 NA
参考答案:B
本题解析:A、乙烯分子中含有6个共用电子对,28g乙烯所含共用电子对数目为6NA,错误;B、正确;C、羟基中含有9个电子,1 mol羟基所含的电子总数为9NA,错误;D、标准状况下,己烷为液体,错误。
本题难度:一般
2、选择题 在1 L 1 mol·L-1的氨水中?
A.含有1 mol NH3分子
B.含NH3和NH4+之和为1 mol
C.含NH3·H2O 1 mol
D.含NH3、NH3·H2O、NH4+之和为1 mol
参考答案:D
本题解析:本题考查氨水的组成。氨气易溶于水,溶于水后大部分与水结合生成一水合氨,而一水合氨属于弱碱,会电离出OH-和NH4+,有关的反应式为:NH3+H2O  NH3?H2O
NH3?H2O OH-+NH4+,因此在氨水中含有H2O、NH3、NH3?H2O、OH-、NH4+和H+,因此选项D正确。
OH-+NH4+,因此在氨水中含有H2O、NH3、NH3?H2O、OH-、NH4+和H+,因此选项D正确。
本题难度:一般
3、填空题 (1)49gH2SO4的物质的量是 ,将其配制成200mL溶液,所得溶液的物质的量浓度为 ,其中含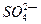 个,该溶液能与标准状况下的氨气 L恰好完全反应生成(NH4)2SO4。
个,该溶液能与标准状况下的氨气 L恰好完全反应生成(NH4)2SO4。
(2)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其PH=1,c(Al3+)="0.4mol/" L, c(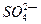 )="0.8" mol/ L, 则c(K+)为 。
)="0.8" mol/ L, 则c(K+)为 。
(3)将标准状况下a L HCl(g)溶于1000 g水中,得到盐酸的密度为bg/ cm3,则该盐酸的物质的量浓度是 。
参考答案:(1) 0.5 , 2.5mol/L, 3.01×1023, 22.4L (2)0.3 mol/L(2分)。
(3)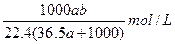 (2分)。
(2分)。
本题解析:略
本题难度:一般
4、填空题 在120℃、101 kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL,(即x=a),则原混合气体中CH4的体积分数是?;
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是?,现要测定原混合气体中H2的体积分数,还必须知道相同条件下的其他数据,可以是?(填选项字母);
A.2a mL混合气体的密度
B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是?。
参考答案:(1)33.3% (2)50% B (3)0.5a<x<2a
本题解析:(1)等体积H2、CO在氧气中完全燃烧时,消耗等体积的氧气,设H2和CO体积和为x,CH4的体积为y,则x+y=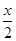 +2y,解得y:x=1:2,所以CH4的体积分数为33.3%。
+2y,解得y:x=1:2,所以CH4的体积分数为33.3%。
(2)同理,H2和CO燃烧生成H2O和CO2体积和为x,CH4燃烧生成2y体积的H2O和y体积的CO2,所以x+3y=2(x+y),解得x:y=1:1,所以CH4的体积分数为50%。
(3)若a mL全部是CO或H2,则完全燃烧时消耗O2的体积为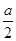 mL;若a mL全部是CH4,则完全燃烧时消耗O2的体积为2a mL,所以得0.5a<x<2a。
mL;若a mL全部是CH4,则完全燃烧时消耗O2的体积为2a mL,所以得0.5a<x<2a。
本题难度:一般
5、实验题 (8分)下图是我校实验室化学试剂浓硫酸标签上的部分内容。
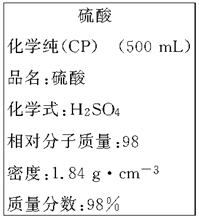
现需要480 mL 1 mol·L-1的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用的仪器有:
①胶头滴管;②玻璃棒;③烧杯;④量筒。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因是________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
参考答案:(1)500 mL的容量瓶 ;(2)27.2 ; > ;(3)①③⑤
本题解析::(1)配制顺序是:计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用量筒(用到胶头滴管)量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:量筒、胶头滴管、烧杯、玻璃棒、100mL容量瓶,故答案为:100 mL的容量瓶、玻璃棒; (2)如图所示浓硫酸的浓度为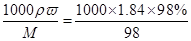 =18.4mol/L.稀释前后溶质的物质的量不发生变化,故18.4mol/LxV=480mlx1mol/L,解得V=27.2ml;若将该浓硫酸与等体积的水混合,硫酸溶质的质量不发生变化,质量分数为
=18.4mol/L.稀释前后溶质的物质的量不发生变化,故18.4mol/LxV=480mlx1mol/L,解得V=27.2ml;若将该浓硫酸与等体积的水混合,硫酸溶质的质量不发生变化,质量分数为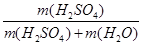 ,由于硫酸的密度大于水的密度,等体积混合硫酸的质量大于水的质量,故质量分数大于49%;(3)根据c=n/V可知,①用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则溶质增加,浓度偏高;②容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,不影响实验结果;③用蒸馏水洗涤量筒,并转移到烧杯中,会使溶质的物质的量偏大,浓度偏高;④转移溶液时,不慎有少量溶液洒到容量瓶外面,则溶质减少,浓度偏小;⑤定容时,俯视容量瓶刻度线进行定容,则容量瓶中溶液体积减少,浓度偏高;⑥定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液体积增加,浓度偏小,故答案为①③⑤.
,由于硫酸的密度大于水的密度,等体积混合硫酸的质量大于水的质量,故质量分数大于49%;(3)根据c=n/V可知,①用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则溶质增加,浓度偏高;②容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,不影响实验结果;③用蒸馏水洗涤量筒,并转移到烧杯中,会使溶质的物质的量偏大,浓度偏高;④转移溶液时,不慎有少量溶液洒到容量瓶外面,则溶质减少,浓度偏小;⑤定容时,俯视容量瓶刻度线进行定容,则容量瓶中溶液体积减少,浓度偏高;⑥定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液体积增加,浓度偏小,故答案为①③⑤.
考点:一定物质的量浓度溶液的配制
本题难度:一般