1、填空题 (12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g)  ?H2(g) + CO(g)?△H =" +131.3" kJ ,△S =" +133.7" J/K
?H2(g) + CO(g)?△H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发?(填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是?。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是?。
(3)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g) N2 (g)+ 3H2(g)的K=?(填数值)。
N2 (g)+ 3H2(g)的K=?(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正?V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1?mol?N2、3mol?H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=?。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是?(填序号)。
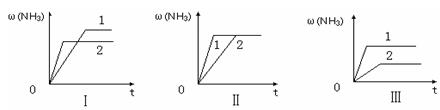
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能:1>2
2、选择题 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%;最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨。下列有关说法中错误的是
A.新的催化剂降低了反应所需要的能量
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源
C.新法合成能在常温下进行是因为催化剂降低了反应的活化能
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
3、选择题 下列关于工业生产的说法中,正确的是
A.工业上用氧气在接触室中氧化黄铁矿得到二氧化硫
B.工业上通过电解饱和氯化钠溶液制备金属钠
C.工业用氨氧化法制硝酸是人工固氮过程
D.生产普通玻璃的主要原料有石灰石、石英和纯碱
4、填空题 从含铜、银、金和铂的块状金属废料中提取铂、金、银的一种工艺如下:
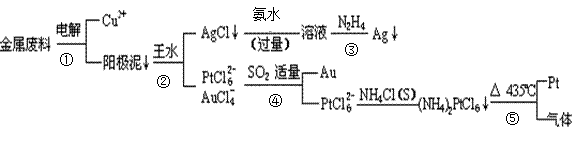
根据以上工艺回答下列问题:
(1)电解时,以_____________为阳极,纯铜为阴极,CuSO4溶液为电解液,则阴极的电极反应方程式为?
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:?
(3)写出步骤④的离子方程式:
?
(4)金和浓硝酸反应的化学方程式为:Au +6HNO3(浓)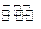 Au(NO3)3+3NO2↑+ 3H2O,因该反应正向进行的程度极小,所以金几乎不溶于浓硝酸,但金却可以溶于王水,试简要解释之:?
Au(NO3)3+3NO2↑+ 3H2O,因该反应正向进行的程度极小,所以金几乎不溶于浓硝酸,但金却可以溶于王水,试简要解释之:?
?
(5)写出反应⑤的化学反应方程式
____________________________________________________________________________
5、选择题 下列有关工业上制硫酸和氨气的说法不正确的是
A.硫酸工业中制SO3的反应条件是:高温、高压、催化剂
B.合成氨气的条件是:400—500 ℃、10Mpa —30 MPa、铁触媒
C.都进行了循环操作
D.都有热交换装置