1、选择题 下列有关化学用语表示正确的是
A.CO2的分子比例模型:
B.质量数为37的氯原子:
C.Mg2+结构示意图:
D.NH4Cl的电子式:
参考答案:C
本题解析:A、二氧化碳是直线形分子,其比例模型是 ,A不正确;B、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,因此质量数为37的氯原子:
,A不正确;B、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,因此质量数为37的氯原子: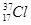 ,B不正确;C、镁离子核外电子数是10个,其结构示意图:
,B不正确;C、镁离子核外电子数是10个,其结构示意图: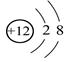 ,C正确;D、NH4Cl的电子式为
,C正确;D、NH4Cl的电子式为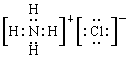 ,D不正确,答案选C。
,D不正确,答案选C。
本题难度:简单
2、填空题 将2.4mol某金属投入1.8L?2mol/L的酸中,恰好完全反应,并得到7.2gH2,则某金属的化合价为______,该酸为______?元酸.
参考答案:n(H2)=7.2g2g/mol=3.6mol,
2.4mol金属共失去电子数为:3.6mol×2=7.2mol,
则1mol金属可失去7.2mol2.4=3mol电子,
所以金属的化合价为+3价;
酸的物质的量为:1.8L×2mol/L=3.6mol,共电离产生的H+的物质的量为:n(H+)=2n(H2)=7.2mol,
则该酸为二元酸,
故答案为:+3;二.
本题解析:
本题难度:一般
3、填空题 (共13分).Ⅰ(6分)、在淀粉KI溶液中加入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,所发生的离子方程式是?,
在上述蓝色溶液中滴加足量的Na2SO3溶液,现象 是? _______________________?,
是? _______________________?,
所发生的离子方程式是?。
Ⅱ(7分)、下面是你熟悉的物质:
① O2?②金刚石 ③ NaBr?④H2SO4?⑤ Na2CO3?⑥ Na2S?⑦ NaHSO4
这些物质中,只含共价键的是_______________;只含离子键的是_______________;既含共价键又含离子键的是________________(以上填序号)
参考答案:
Ⅰ、ClO-+2I-+2H+==Cl-+I2+H2O;蓝色逐渐消失;SO32-+I2+H2O="=" SO42-+2I-+2H+?(各2分)
Ⅱ、①②④(3分); ③⑥(2分); ⑤⑦(2分)
本题解析:略
本题难度:一般
4、简答题 7.8g过氧化钠投入足量水中生成的气体在标准状况下的体积是多少升?若把生成的溶液用2mol/L的硫酸来完全中和,需硫酸溶液的体积是多少?
参考答案:n(Na2O2)=7.8g78g/mol=0.1mol,
2Na2O2+2H2O=4NaOH+O2↑
2mol? 4mol? 22.4L
0.1mol?n? V
n(NaOH)=0.2mol,V(O2)=1.12L,
H2SO4+2NaOH=Na2SO4+2H2O
1? ?2
n(H2SO4)? 0.2mol
n(H2SO4)=0.1mol,
V(H2SO4)=0.1mol2mol/L=0.05L.
答:生成的气体在标准状况下的体积是1.12L,需硫酸溶液的体积是0.05L.
本题解析:
本题难度:一般
5、实验题 (14分)下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
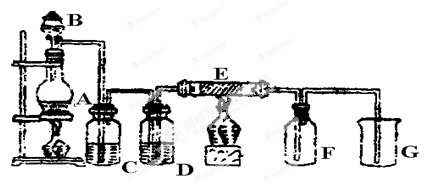
(1)A中发生的化学反应的离子方程式为 。
(2)C中盛装的药品__________;
(3)E反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2与SO2等物质的量通入水中则无漂白作用,试写出化学方程式 。
(6)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①当有0.2mole-转移时被氧化的HCl的质量是 ;
②如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将 。
A.≥1.68L
B.>1.68L
C.≤1.68L
D.<1.68L