1、计算题 在密闭容器中,放入(NH4)2C O3和NaOH的混合物共ag,将容器加热至200℃,经充分反应后,排除其中的气体,冷却,称得剩余固体质量为bg,求容器中(NH4)2CO3和NaOH各多少克?
O3和NaOH的混合物共ag,将容器加热至200℃,经充分反应后,排除其中的气体,冷却,称得剩余固体质量为bg,求容器中(NH4)2CO3和NaOH各多少克?
参考答案:m(NaOH)=40×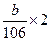 ?m((NH4)2CO3)=a-40×
?m((NH4)2CO3)=a-40×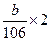
本题解析:(本题中ag(NH4)2CO3和NaOH的混合物,在加热时(NH4)2CO3与NaOH要发生反应,因
② 若(NH4)2CO3过量,剩余的(NH4)2CO3在加热时还要分解生成NH3、H2O和CO2气体,则此时bg固体全部是Na2CO3。根据钠元素质量守恒有
n(NaOH)=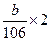 , 则m(NaOH)=40×
, 则m(NaOH)=40×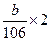
m((NH4)2CO3)=a-40×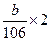
本题难度:简单
2、选择题 下列关于钠的氧化物的叙述正确的是
[? ]
A.Na2O2是白色固体,和冷水作用得到O2和NaOH
B.Na2O2与SO2的反应中,Na2O2既是氧化剂,又是还原剂
C.Na2O2中阴阳离子个数比为1∶2
D.都能与酸反应,生成含氧酸盐,都是碱性氧化物
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列有关NaHCO3和Na2CO3性质的比较中,正确的是(? )
A.热稳定性:Na2CO3<NaHCO3
B.常温时在水中的溶解度:Na2CO3<NaHCO3
C.等质量的NaHCO3和Na2CO3与稀盐酸反应产生CO2的量:Na2CO3<NaHCO3
D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多
参考答案:C
本题解析:
A.不正确,热稳定性:Na2CO3>NaHCO3; B.不正确,常温时在水中的溶解度:Na2CO3>NaHCO3;
C.正确; D.不正确,等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2一样多。选C。
本题难度:简单
4、填空题
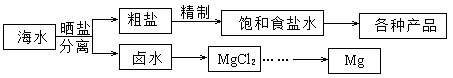
(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是?。
②实验室用惰性电极电解100mL0.1mol/L NaCl溶液,若阴阳两极均得到11.2mL气体(标准状况),则所得溶液的pH为?(忽略反应前后溶液的体积变化)。
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的化学方程式:?。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。粗产品的溶液中含有Na+、Fe2+,Fe3+和Mn2+,需将Fe2+、Fe3+和Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为?,控制溶液的pH为?。
物 质
| 开始沉淀
| 沉淀完全
| 物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)2
| 2.7
| 3.7
| Mn(OH)2
| 8.3
| 9.8
|
Fe(OH)3
| 7.6
| 9.6
| Mg(OH)2
| 9.9
| 11.1
|
?
参考答案:
(1)①2NaCl+2H2O=2NaOH+H2↑+Cl2↑②13③NaCl+H2O NaClO+H2↑
NaClO+H2↑
(2)NaClO或氯气,9.8
本题解析:
海水中氯化钠的含量十分丰富,NaCl为重要的化工原料。(1)①NaCl为离子化合物,电解其熔融物,钠离子得电子生成熔融金属钠,Cl-离子失电子得到Cl2;②电解氯化钠溶液反应的化学方程式为:2NaCl+2H2O=2NaOH+H2↑+Cl2↑,n(NaOH)=n(H2)=2×112mL/22400mL·mol-1=0.01 mol,c(OH-)="c(NaOH)=0.01mol/0.1L=0.1" mol·L-1,溶液的pH为14-lg0.1=13。③电解NaCl溶液制备84消毒液是将电解产生的Cl2与电解产生的NaOH反应生成NaClO,故该电解反应方程式为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
(2)将Fe2+离子转化为Fe3+离子需要加入氧化剂,可以选用NaClO或氯气,要使沉淀杂质沉淀完全,需要调整溶液的pH为9.8,过高Mg(OH)2会产生沉淀。
本题难度:简单
5、填空题 有人设计了如右图的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。
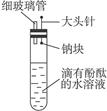
(1)为了完成他的实验,还需要的仪器有___________________________________________。
(2)假如已按如图所示装配好了仪器,接下来的操作是______________________________。
(3)实验现象是________________________________________________________________。
参考答案:(1)小试管、酒精灯(2)将大头针向上提,使钠块从针头脱落并落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口移近酒精灯,松开拇指点燃试管中的气体
(3)钠浮在水面上,很快熔化成闪亮的小球,并逐渐消失,水溶液由无色变成红色;反应有气体生成,点燃小试管中的气体时,有尖锐的爆鸣声
本题解析:(1)钠与水反应的化学方程式为:2Na+2H2O====2NaOH+H2↑。生成的NaOH能通过滴有酚酞的水溶液变红来检验,生成的H2则应该收集后再进行点燃实验,故还需要用到小试管和酒精灯。(2)接下来的操作是让钠与水接触开始反应,并观察现象、收集和验证产生的气体是否是氢气。
本题难度:简单