1、选择题 可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是(? )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清的石灰水有白色沉淀生成
参考答案:C
本题解析:A项中碳酸钠在加热时气体放出,但并不能由此证明就一定含有碳酸钠,A错误。B项中碳酸氢钠和碳酸钠都可以与盐酸反应放出气体CO2,B错误。C项中溶于水之后,NaHCO3====Na++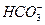 、Na2CO3====2Na++
、Na2CO3====2Na++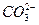 ,再滴加BaCl2出现白色沉淀,这一定是BaCO3沉淀,则原混合物中有Na2CO3,C正确。D项中溶于水后滴加澄清的石灰水有如下反应:NaHCO3+Ca(OH)2====CaCO3↓+H2O+NaOH、2NaHCO3+Ca(OH)2====CaCO3↓+ Na2CO3+2H2O。如果有碳酸钠也有下列反应:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH↓。所以无法判断白色沉淀的产生是缘于NaHCO3还是Na2CO3,D错误。
,再滴加BaCl2出现白色沉淀,这一定是BaCO3沉淀,则原混合物中有Na2CO3,C正确。D项中溶于水后滴加澄清的石灰水有如下反应:NaHCO3+Ca(OH)2====CaCO3↓+H2O+NaOH、2NaHCO3+Ca(OH)2====CaCO3↓+ Na2CO3+2H2O。如果有碳酸钠也有下列反应:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH↓。所以无法判断白色沉淀的产生是缘于NaHCO3还是Na2CO3,D错误。
本题难度:简单
2、填空题 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1.1
| 3.2
|
Al3+
| 3.0
| 5.0
|
Fe2+
| 5.8
| 8.8
|
?
(1)制备FeCO3时,选用的加料方式是________(填字母),原因是_________________________________
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是__________________。

(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,________,得到FeSO4溶液,________,得到FeSO4·7H2O晶体。
参考答案:(1)c 避免生成Fe(OH)2沉淀 (2)取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 (3)①防止+2价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全 (4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出 (5)“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤” (滴加稀硫酸酸化,)加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
本题解析:根据题干信息以及FeCO3、Fe2O3、FeSO4的性质解决问题。
(1)根据相关金属离子生成氢氧化物沉淀的pH可知,制备FeCO3时要注意控制溶液的pH。所以需要将Na2CO3缓慢加入到FeSO4溶液中,防止Fe(OH)2的生成。
(2) FeCO3表面吸附SO42—、Na+等杂质离子,检验洗涤是否完全时,可检验SO42—是否存在。方法是取最后一次的洗涤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)Fe2+易被氧化,加入铁粉的目的是防止Fe2+被氧化。除去剩余的铁粉时,为了不引入杂质,可加入适量柠檬酸与铁粉反应。(4)柠檬酸亚铁在乙醇中的溶解度小,加入无水乙醇,有利于晶体的析出。(5)烧渣中加入稀H2SO4后要通过过滤除去SiO2,此时溶液中溶质主要是Fe2(SO4)3和Al2(SO4)3。此时需要加入Fe粉,将Fe3+转化为Fe2+,然后加NaOH调pH到5.0除去Al3+。或过滤,除去SiO2后,向滤液中加入过量的NaOH溶液,过滤,得到Fe(OH)3,洗涤沉淀,加入足量的稀硫酸至沉淀溶解完全,再加入足量的铁粉,得到FeSO4。过滤后,将滤液在60℃时浓缩,冷却即可。
点拨:知识:物质的制备、除杂、净化等实验操作。能力:考查基础知识的同时,也考查了学生读图、识表的综合能力。试题难度:中等。
本题难度:困难
3、选择题 下列金属的冶炼方法不正确的是: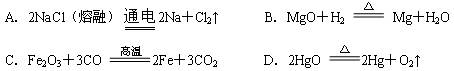
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列物质反应后一定有+3价铁生成的是
[ ? ]
①过量的Fe与Cl2反应 ②Fe与过量稀H2SO4反应后,再向其中加入KNO3
③Fe和Fe2O3的混合物溶于盐酸中
A.①?
B.①③
C.①②?
D.全部
参考答案:C
本题解析:
本题难度:简单
5、选择题 把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为?(?)
A.1:1
B.1:2
C.2:3
D.3:2
参考答案:C
本题解析:
Fe +2Fe3+=3Fe2+
1? 2? 3
从上述离子方程式得,若反应2molFe3+(即已反应的Fe3+),生成3molFe2+而所得溶液中Fe2+和Fe3+的溶度恰好相等,即未反应的Fe3+的物质的量为3mol所以答案2:3,故选C。3+和Fe2+的转换的计算
点评:本题考查Fe3+和Fe2+的转换的计算,只需列出反应方程式,通过假设即可算出,不难理解。
本题难度:一般