1、选择题 将2mol?NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为
A.1~2mol之间
B.1~4mol之间
C.2~4mol之间
D.大于4mol
参考答案:B
本题解析:分析:2molNaHCO3分解生成1molNa2CO3、1molH2O和1molCO2.生成的1molH2O和1molCO2会和Na2O2固体反应,可采用极值法来计算.
解答:加热后,发生反应如下:
2NaHCO3 Na2CO3 +H2O+CO2↑,
Na2CO3 +H2O+CO2↑,
2mol? ?1mol 1mol 1mol
2Na2Oz+2CO2═2Na2CO3+O2
1mol 1mol
2Na2Oz+2H2O═4NaOH+O2↑
1mol 2mol
由反应方程式可知,若无Na2O2固体存在时,2mol NaHCO3分解生成1molNa2CO3;
若2mol NaHCO3分解生成的H2O和CO2被足量的Na2O2吸收时,还可生成1mol Na2CO3和2molNaOH,所以固体最多不超过4mol.
故选:B.
点评:本题考查了碳酸氢钠的性质及过氧化钠的性质及有关计算.搞清反应原理,找出各量之间的关系是解题的基础,对于范围类的题目,常采用极值法进行计算.
本题难度:困难
2、选择题 下列离子方程式错误的是
A.用Na2CO3溶液作洗涤剂:CO32-+2H2O?H2CO3+2OH-
B.用铜作电极电解氢氧化钠溶液:2H2O?2H2↑+O2↑
C.“银镜反应”:RCHO+2Ag(NH3)2++2OH-?2Ag+RCOO-+NH4++3NH3+H2O
D.交警用酸化的含Cr2O72-的硅胶检测司机酒后驾驶的反应:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O
参考答案:AB
本题解析:分析:A、碳酸根离子是多元弱酸阴离子分步水解;
B、电解池中铜做阳极铜失电子发生氧化反应;
C、醛基被银氨溶液氧化为醋酸,结合氨气生成醋酸铵;
D、重铬酸根离子具有强氧化性能氧化乙醇为乙酸,本身颜色变化.
解答:A、用Na2CO3溶液作洗涤剂,因为碳酸根离子水解显碱性:CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+2OH-,故A错误;
B、用铜作电极电解氢氧化钠溶液,铜做阳极是活性电极,铜失电子发生氧化反应:Cu+2H2O? ?2H2↑+Cu(OH)2↓,故B错误;
?2H2↑+Cu(OH)2↓,故B错误;
C、醛基被银氨溶液氧化为醋酸,结合氨气生成醋酸铵;“银镜反应”的离子方程式为:RCHO+2Ag(NH3)2++2OH-?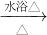 ?2Ag+RCOO-+NH4++3NH3+H2O,故C正确;
?2Ag+RCOO-+NH4++3NH3+H2O,故C正确;
D、重铬酸根离子具有强氧化性能氧化乙醇为乙酸,本身颜色变化,反应的离子方程式为:2Cr2O72-+3C2H5OH+16H+=4Cr3++3CH3COOH+11H2O,故D正确;
故选AB.
点评:本题考查离子方程式的书写方法和注意问题,反应实质的理解和掌握是解题关键,题目难度中等.
本题难度:简单
3、选择题 下列离子方程式正确的是
A.硫酸铁溶液中通入过量的硫化氢气体:2Fe3++3H2S=2FeS↓+S↓+6H+
B.苯酚钠溶液中通入少量的二氧化碳气体:
C.NaHSO4溶液中滴入足量的Ba(OH)2溶液:2H++SO42-+Ba2++OH-=BaSO4↓+2H2O
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-CH3COO-+NH4++2Ag↓+3NH3+H2O
参考答案:D
本题解析:分析:A.不生成FeS沉淀;
B.应生成HCO3-;
C.应满足n(H+):n(SO42-)=1:1;
D.乙醛和银氨溶液发生氧化还原反应生成Ag和乙酸.
解答:A.硫酸铁溶液中通入过量的硫化氢气体,应为2Fe3++H2S=2Fe2++S↓+2H+,故A错误;
B.苯酚酸性大于HCO3-,应生成HCO3-,故B错误;
C.NaHSO4溶液中滴入足量的Ba(OH)2溶液,反应的离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C错误;
D.乙醛和银氨溶液发生氧化还原反应生成Ag和乙酸,反应的离子方程式为CH3CHO+2Ag(NH3)2++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O,故D正确.
CH3COO-+NH4++2Ag↓+3NH3+H2O,故D正确.
故选D.
点评:本题考查离子方程式的书写,注意物质的化学式的书写,从守恒的角度判断离子方程式的正误,特别要注意离子方程式必须遵循反应实际,易错点为C,注意酸性强弱的比较,题目难度不大.
本题难度:困难
4、选择题 氯气、液氯、盐酸、氯水中均含有
A.氯分子
B.氯原子
C.氯离子
D.氯元素
参考答案:D
本题解析:此类题选择防毒的合适物质必须考虑三个方面:一是要能够吸收氯气;二是本身无毒、无腐蚀性,对人体无害;三是吸收氯气时生成的产物也应对人体无害。
本题难度:困难
5、选择题 下列各组金属最合适用氢气或CO把它们从化合物中还原出来的是
A.Ca、Mg
B.Al、Fe
C.Fe、Cu
D.Hg、Ag
参考答案:C
本题解析:在金属活动顺序表中,位于氢后面的金属(如Hg、Ag等),适合用热分解法冶炼;位于氢前面的几种很活泼的金属(如K、Na、Mg、Ca、Al等)适合用电解其熔融盐或氧化物的方法来冶炼;多数金属(如Fe、Cu等)的冶炼可用热还原法。
本题难度:困难