1、选择题 现有钠、镁、铝质量分别为2.3g、2.4g、2.7g,使其分别于足量的盐酸溶液充分反应后,所得H2的质量关系正确的是
A.氢气质量相同
B.钠放出氢气最多,镁铝相同
C.钠放出氢气最多,铝最少
D.铝放出氢气最多,钠最少
参考答案:D
本题解析:分析:根据n=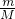 计算各金属的物质的量,盐酸足量,金属完全反应,根据电子转移守恒计算生成的氢气的物质的量,据此判断.
计算各金属的物质的量,盐酸足量,金属完全反应,根据电子转移守恒计算生成的氢气的物质的量,据此判断.
解答:2.3gNa的物质的量为 =0.1mol,反应中Na表现+1价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Na表现+1价,金属完全反应,故生成氢气的物质的量为 =0.05mol,
=0.05mol,
2.4gMg的物质的量为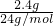 =0.1mol,反应中Mg表现+2价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Mg表现+2价,金属完全反应,故生成氢气的物质的量为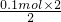 =0.1mol,
=0.1mol,
2.7g的物质的量为 =0.1mol,反应中Al表现+3价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Al表现+3价,金属完全反应,故生成氢气的物质的量为 =0.15mol,
=0.15mol,
氢气的物质的量越大,其质量越大,故选D.
点评:本题考查金属与酸的反应的计算,题目难度中等,注意盐酸过量金属完全反应.
本题难度:一般
2、选择题 下列物质既能与酸反应又能与碱反应的是
A.NaCl
B.NaOH
C.BaCl2
D.NaHCO3
参考答案:D
本题解析:A不行, NaCl不与酸反应,也不与碱反应.
B不行,只能和酸反应.
C不行,不能和酸反应,也不能和碱反应.
D可以, 与酸反应:NaHCO3+HCl= NaCl+H2O+CO2↑与碱反应: NaHCO3+ NaOH=Na2CO3+H2O.正确答案选D.
本题难度:困难
3、选择题 下列物质中,既能跟盐酸反应又能跟氢氧化钠溶液反应的是
A.Al(OH)3
B.NaAlO2
C.AlCl3
D.Fe
参考答案:A
本题解析:分析:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答:A.氢氧化铝是两性氢氧化物,能与盐酸反应生成氯化铝与水,与氢氧化钠反应生成偏铝酸钠与水,故A符合;
B.NaAlO2与盐酸反应生成氯化铝,与氢氧化钠不反应,故B不符合;
C.AlCl3能与氢氧化钠溶液反应生成氢氧化铝或偏铝酸钠,不与盐酸反应,故C不符合;
D.Fe只能与盐酸反应生成氯化亚铁与氢气,不能与氢氧化钠溶液反应,故D不符合;
故选A.
点评:本题考查了物质的性质,难度不大,旨在考查学生对知识的理解识记与知识归纳,明确物质的性质是解本题的关键,注意基础知识的积累.
本题难度:一般
4、选择题 下列说法错误的是
A.不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性
B.医疗上用的“钡餐”其成分是硫酸钡,漂白粉的成分为次氯酸钙
C.SO2能够使酸性KMnO4溶液褪色是因为其具有还原性
D.铝制容器不能长期盛装酸性或碱性食品
参考答案:B
本题解析:分析:A、铜与浓硝酸反应生成硝酸铜与二氧化氮,与稀硝酸反应生成硝酸铜与NO,结合N元素化合价判断;
B、漂白粉的成分为次氯酸钙、氯化钙,有效成分是次氯酸钙;
C、SO2中硫元素化合价为+4,具有还原性,可以被强氧化剂氧化;
D、Al放置在空气中被氧化为氧化铝,氧化铝具有两性,既能与酸反应又能与碱反应,且Al与酸或碱都能发生反应,以此来解答.
解答:A、铜与浓硝酸反应生成硝酸铜与二氧化氮,与稀硝酸反应生成硝酸铜与NO,反应中生成硝酸铜中N元素化合价未变化,表现硝酸的酸性,生成二氧化氮、NO,氮元素的化合价降低,表现硝酸的强氧化性,故A正确;
B、医疗上用的“钡餐”其成分是硫酸钡,漂白粉的成分为次氯酸钙、氯化钙,有效成分是次氯酸钙,故B错误;
C、酸性KMnO4溶液具有强氧化性,SO2中硫元素化合价为+4,具有还原性,可以被酸性KMnO4溶液氧化,使酸性KMnO4溶液褪色,故C正确;
D、Al放置在空气中被氧化为氧化铝,氧化铝与酸性食品和碱性食品均能反应生成盐和水,长期盛装酸性或碱性食品,氧化铝膜反应,且Al与酸或碱都能发生反应,被腐蚀,故D正确;
故选B.
点评:本题考查硝酸、铝及化合物、二氧化硫性质等,难度不大,注意基础知识的理解掌握.
本题难度:简单
5、选择题 为了检验氯化亚铁溶液是否已变质,可向溶液中加入
A.氢氧化钠溶液
B.铁片
C.KSCN溶液
D.石蕊试液
参考答案:C
本题解析:氯化亚铁溶液易被氧化为Fe3+,检验Fe3+的试剂为KSCN溶液.
本题难度:困难