1、选择题 白磷与氧可发生如下反应:P4+5O2===P4O10.已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P==="O" c kJ/mol、O==="O" d kJ/mol.根据右图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是
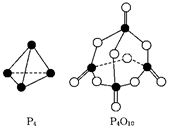
A.(4c+12b-6a-5d) kJ/mol
B.(6a+5d-4c-12b) kJ/mol
C.(4c+12b-4a-5d) kJ/mol
D.(4a+5d-4c-12b) kJ/mol
参考答案:B
本题解析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据物质的结构可知,该反应的反应热△H=(6a+5d-4c-12b) kJ/mol,答案选B。
本题难度:简单
2、选择题 比较法是研究物质化学性质的一种重要的方法,下面有关叙述,其中正确的是
A.Na2O和Na2O2都是钠的氧化物,都属于碱性氧化物
B.Na2O和Na2O2都能与二氧化碳或水发生化合反应
C.Na2O和Na2O2长期置于空气中最终剩余固体物质相同
D.Na2O和Na2O2分别与CO2反应,发生的都是氧化还原反应
参考答案:C
本题解析:分析:A、碱性氧化物是指能与酸反应生成盐和水的氧化物或与水反应生成相应碱的氧化物;
B、两种或两种以上的物质反应生成一种物质的反应属于化合反应,过氧化钠与二氧化碳或水反应,生成物不止一种;
C、Na2O和Na2O2长期置于空气中,经过一系列转化后最终生成碳酸钠;
D、氧化钠与二氧化碳反应生成碳酸钠,元素化合价没有变化.
解答:A、氧化钠与水反应生成氢氧化钠,属于碱性氧化物,过氧化钠与水反应生成氢氧化钠与氧气,发生氧化还原反应,过氧化钠不是碱性氧化物,故A错误;
B、氧化钠与二氧化碳反应生成碳酸钠,与水反应生成氢氧化钠,属于化合反应,过氧化钠与水反应生成氢氧化钠与氧气,与二氧化碳反应生成碳酸钠与氧气,不属于化合反应,故B错误;
C、Na2O和Na2O2长期置于空气中,经过一系列转化后最终生成碳酸钠,故C正确;
D、氧化钠与二氧化碳反应生成碳酸钠,元素化合价没有变化,不属于氧化还原反应,过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应中氧元素化合价发生变化,属于氧化还原反应,故D错误;
故选C.
点评:本题考查钠的重要化合物、化学基本概念等,难度不大,注意对碱性氧化物概念的理解,与酸或水反应为非氧化还原反应,与水反应应是化合反应.
本题难度:一般
3、选择题 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是(?)
①生成物的体积分数一定增加?
②生成物的产量一定增加?
③反应物的转化率一定增加?
④反应物的浓度一定降低?
⑤正反应速率一定大于逆反应速率
A.①②④⑤
B.①②③⑤
C.②③
D.②⑤
参考答案:D
本题解析:题中给定了平衡的移动方向,要求判断引起平衡移动的原因及可能产生的结果。平衡向正方向移动,由于改变条件不明,反应物的转化率、浓度均无法确定,则应具体分析使平衡发生移动的原因。若是通过改变温度或改变压强使平衡发生移动,①③④所述情况是成立的;若是通过增加反应物的浓度使平衡向正方向移动,若增加反应物的量很多,生成物体积分数必然降低(混合气体的总物质的量增加),该反应物的浓度较原浓度增大(增加部分较原转化的浓度要少),该物质的转化率较低,故①③④均不确定。由于反应向正方向移动,生成更多的生成物,生成物的量必然增加,故②正确;平衡向正方向移动,必是正反应速率大于逆反应速率的结果,故⑤正确。
本题难度:困难
4、选择题 下列有机物分子在氢核磁共振谱中只给出一种信号的是
A.HCHO
B.CH3OH
C.HCOOH
D.CH3COOCH3
参考答案:A
本题解析:
本题难度:困难
5、选择题 在pH=1的溶液中,因发生氧化还原反应而不能大量共存的是
A.Na+? SO32-? K+? S2-
B.Al3+? AlO2-? Na+? NO3-
C.Na+? SO42- ? H2PO4-? CO32-
D.Fe2+? Cl-? Na+? NO3-
参考答案:AD
本题解析:在酸性条件下,A项中SO32-与S2-会因发生氧化还原反应而不能大量共存;B、C中是弱酸根离子的缘故;D项中Fe2+与NO3-会因发生氧化还原反应而不能大量共存。
本题难度:简单