1、选择题 下列实验能达到预期目的的是(?)?
①用蒸馏的方法可将海水淡化 ②除去CO2中混有的CO:通入适量氧气点燃
③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO ④加入适量的盐酸可除去FeCl3溶液中的Fe(OH)3胶体
A.①②
B.②③
C.①④
D.③④
2、实验题 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
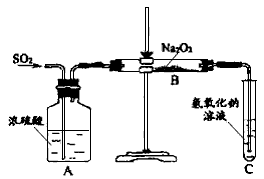
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:_____________
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
_________________________________
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有
Na2SO4生成,他们设计了如下方案:

上述方案是否合理?___________。请简要说明两点理由:①______________;②_____________。
3、实验题 (15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1?KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH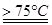 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是?;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是?。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是?;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是?。

(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
?。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e—?C12↑阴极:2H2O+2e—?H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1—? HC1O
HC1O+H++C1—? HC1O H++C1O—
H++C1O—
2HC1O+CO—?C1O3—+2C1—+2H+
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂
是?、?、?;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止?(填离子符号)电解过程中在阴极上放电。
(4)若NaC1O3与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为?(填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O7标准溶液滴定至终点。
步骤4:?。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是?。
②步骤3中K2Cr2O2标准溶液应盛放在?中(填仪器名称)。
③为了确定样品中C1O3—的质量分数,步骤4的操作内容是?。
4、填空题 (14分)某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
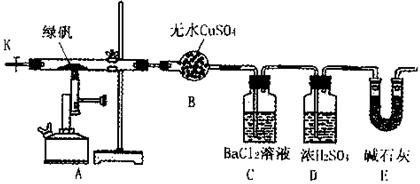
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为:?;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为:?;
(3)实验小组的报告如下,请补充完整:
?
| 实验记录
| 分析或计算结果
|
现象
| 硬质管内绿色变为红棕色;
| 生成物有?
|
干燥管B中晶体白色变蓝色。
| 生成物有H2O
|
数据
| 称取绿矾样品16.68g;
| 反应的绿矾0.06mol
|
干燥管E最后增重2.24g;
| 生成SO2?mol
|
C中生成白色沉淀的质量为4.66g;
| 生成DO3 0.02mol
|
?(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
5、实验题 溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是______________(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是______________。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测

方案1是否合理______________(填“合理”或“不合理”)。 方案2中,由于存在反应____________________________(用离子方程式表示),所以预测结论不正确。
(3)请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
