1、推断题 A~H等8种物质存在如图所示转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
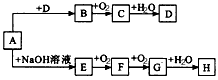
(1)写出下列物质的化学式:A___________,B_________,C_________。
(2)写出下列反应的化学方程式:E→F__________________________________;G→H__________________________________;D的浓溶液与木炭反应的方程式:____________________。
(3)检验某溶液中是否含D中阴离子的方法是_______________________。
参考答案:(1)(NH4)2SO3;SO2;SO3
(2)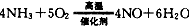 ,3NO2+H2O = 2HNO3+NO,
,3NO2+H2O = 2HNO3+NO, 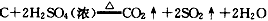
(3)取少量该溶液于试管中,加足量盐酸酸化,未见白色沉淀,然后加入氯化钡溶液有白色沉淀,说明含有硫酸根离子
本题解析:
本题难度:一般
2、推断题 下方图中A~K均为中学化学中常见的物质,其中A和F是金属单质,D是最常见的溶剂。I为黄绿色气体,C的焰色反应呈黄色,K是红褐色固体。
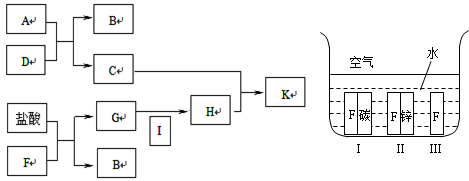
(1)A元素在周期表中位于第?周期?族?。
(2)G+I→H的离子方程式为?。
(4)如上方右图所示,F处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,该金属被腐蚀的速率由快到慢的顺序是(填序号)_______________。
参考答案:(6分)
(1)第? 3?周期? ⅠA?族。
(2)离子方程式为? 2Fe2++Cl2=2Fe3++2Cl-?。
(4)由快到慢的顺序是(填序号) Ⅰ>Ⅲ>Ⅱ 。
本题解析:C的焰色反应呈黄色,应含有Na元素,则A应为Na,D是最常见的溶剂,应为H2O,A和D反应生成NaOH和H2,则C为NaOH,B为H2,I为黄绿色气体,应为Cl2,K是红褐色固体,应为Fe(OH)3,则H为FeCl3,G为FeCl2,F为Fe,
(1)由以上分析可知A为Na,原子核外有3个电子层,最外层电子数为1,应位于周期表第三周期、ⅠA族,
故答案为:三;ⅠA;
(2)D为H2O,I为Cl2,二者反应生成HCl和HClO,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,G为FeCl2,具有还原性,可被Cl2氧化生成FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Cl2+H2O=H++Cl-+HClO; 2Fe2++Cl2=2Fe3++2Cl-;
(3)G为FeCl2,含有Fe2+,加入KSCN溶液不变色,但Fe2+具有还原性,可被H2O2氧化为Fe3+,溶液变红,
故答案为:H2O2、KSCN;
(4)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护,则该金属被腐蚀的速率由快到慢的顺序是Ⅰ>Ⅲ>Ⅱ,故答案为:Ⅰ>Ⅲ>Ⅱ。
点评:本题考查元素化合物的推断,难度不大,可根据物质的特殊颜色或特殊化学反应推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,学习中注意把握金属腐蚀快慢的比较。
本题难度:困难
3、选择题 下列物质不能使品红溶液褪色的是?(?)
A.氯气
B.硫化氢
C.二氧化硫
D.过氧化钠
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (8 分)下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体,E为单质。
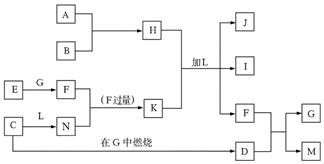
试填写下列空白:
(1)写出F的化学式:? _______________。
(2)写出M发生水解的化学反应方程式__________________。
(3)反应C+G→D的化学方程式是_______________。
(4)写出H 、K加L生成J、I、F反应的离子方程式_______________。
参考答案:(每小题2分)
(1)CO2 (2)(2分)?(3)2Na+O2 Na2O2 (4)Al3++3HCO3-==Al(OH)3↓+3CO2↑
Na2O2 (4)Al3++3HCO3-==Al(OH)3↓+3CO2↑
本题解析:略
本题难度:简单
5、简答题 铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如图所示工艺流程:
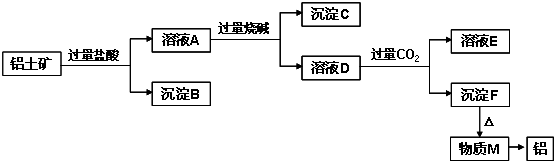
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是______(填操作名称).
(2)沉淀B的成分是______(填化学式,下同),B可以用来制普通玻璃,化学方程式是______,______;沉淀C的成分是______;溶液D中存在较多的阴离子是______.
(3)沉淀F转化为物质M的化学方程式为______;由物质M制取铝的化学方程式为______;溶液D中通入过量CO2生成沉淀F的离子方程式为______.
参考答案:Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al,
(1)分离溶液与沉淀,常用过滤的方法,故答案为:过滤;
(2)由以上分析可知沉淀B的成分是SiO2,工业常用纯碱、石灰石和石英为原料制造玻璃,反应的相关方程式为Na2CO3+SiO2高温.Na2SiO3+CO2↑、CaCO3+SiO2高温.CaSiO3+CO2↑,沉淀C为Fe(OH)3和Mg(OH)2,溶液D主要成分为NaAlO2,还含有过量的NaOH和NaCl,则溶液中存在的阴离子为AlO2-,OH-,Cl-,
故答案为:SiO2;Na2CO3+SiO2高温.Na2SiO3+CO2↑;CaCO3+SiO2高温.CaSiO3+CO2↑;
Fe(OH)3和Mg(OH)2;AlO2-,OH-,Cl-;
(3)沉淀F为Al(OH)3,加热分解得到M为Al2O3,方程式为2Al(OH)3△.Al2O3+3H2O,Al2O3经电解可得到
Al,方程式为2Al2O3(熔融)电解.冰晶石4Al+3O2↑,溶液NaAlO2中通入过量CO2生成Al(OH)3沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al(OH)3△.Al2O3+3H2O;2Al2O3(熔融)电解.冰晶石4Al+3O2↑;
CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-.
本题解析:
本题难度:一般