1、简答题 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于?50mL密度为?1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示.请依图回答下列问题:
(1)实验时放出气体的总体积为______;
(2)放出一半气体所需要的时间为______;
(3)ABCD四点化学反应速率的由快到慢顺序为______
(4)解释反应速率的大小变化原因______
;
(5)在5min后,收集到的气体体积不再增加,原因是______.
参考答案:(1)由反应方程式为:2H2O2?MnO2?.?2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,故答案为:60ml;?
(2)由图象可知,当时间进行到1min时,需要的时间为1min,故答案为:1?min;?
(3)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;?
(4)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小;?
(5)该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
故答案为:此时双氧水已完全分解.
本题解析:
本题难度:一般
2、填空题 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,

请回答下列问题:
(1)写出该反应的化学方程式: 。
(2)0-6 s内,B的平均反应速率为: 。
(3)下列说法正确的是( )
A.反应进行到1 s时,v(A)=v(D)
B.反应进行到6 s时,各物质的反应速率相等
C.反应进行到6 s时反应停止。
D.当反应达到平衡状态时4v(A)=5v(C)
参考答案:18.(1)3B+4C 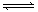 5A+2D (2)0.05 mol·L-1·s-1 (3)D
5A+2D (2)0.05 mol·L-1·s-1 (3)D
本题解析:(1)当反应进行到6s时达到平衡状态,根据曲线变化可知AD是反应物,BC是生成物,各物质平衡后都存在,该反应为可逆反应,再根据物质的量变化之比等于化学计量数之比,ABCD四种物质的物质的量变化为1、0.6、0.8、0.4,则该反应的化学方程式为:3B+4C 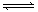 5A+2D;
5A+2D;
(2)0-6 s内,B的平均反应速率为0.6mol/(2L×6s)= 0.05 mol·L-1·s-1;
(3)A.化学反应速率之比等于化学计量数之比,v(A)不等于v(D),错误;B.反应进行到6 s时,各物质的反应速率不相等,错误;C.反应进行到6 s时达到平衡状态,但反应并未停止,错误;D.当反应达到平衡状态时4v(A)=5v(C),正确;选D。
考点:考查化学平衡图像,化学反应速率的计算等知识。
本题难度:一般
3、选择题 在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应:
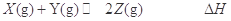
在反应过程中,X的物质的量与时间的关系如下表所示:
t/min
| 0
| 2
| 4
| 6
| 8
| ……
| 16
| 18
|
n(X)/mol
| 1.600
| 1.200
| 1.100
| 1.075
| ……
| ……
| 1.000
| 1.000
|
下列说法不正确的是
A.4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L·min)
B.此温度下该反应的平衡常数K=1.44
C.达平衡后,升高温度,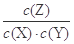 减小,则正反应
减小,则正反应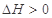
D.若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变
参考答案:C
本题解析:A、4~6min时间段内X的物质的量减少1.1-1.075=0.025mol,所以Z的物质的量增加0.05mol,所以用Z表示的反应速率是0.05mol/10L/2min="0.0025" mol/(L·min),正确;B、16min时,反应达到平衡状态,此时X的物质的量浓度是1.000mol/10L=0.1mol/L,则Y的平衡浓度也是0.1mol/L,Z的平衡浓度是(1.6/10mol/L-0.1mol/L) ×2=0.12mol/L,所以该反应在该温度的平衡常数是0.122/0.12=1.44,正确;C、达平衡后,升高温度,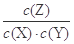 减小,说明平衡逆向移动,则正向是放热反应,所以△H<0,错误;D、若保持其他条件不变,再充入1.6molZ,因为生成物只有Z,所以相当于增大压强,而增大压强对该反应的平衡无影响,平衡不移动,Z的体积分数不变,正确,答案选C。
减小,说明平衡逆向移动,则正向是放热反应,所以△H<0,错误;D、若保持其他条件不变,再充入1.6molZ,因为生成物只有Z,所以相当于增大压强,而增大压强对该反应的平衡无影响,平衡不移动,Z的体积分数不变,正确,答案选C。
考点:考查对化学平衡的分析,平衡常数、反应速率的计算,平衡移动的判断
本题难度:困难
4、选择题 在一固定容积的反应器中发生反应:2SO2+O2 2SO3,下列三种情况,其中开始反应时反应速率最快,达到平衡时,SO2的转化率最低的是(? )
2SO3,下列三种情况,其中开始反应时反应速率最快,达到平衡时,SO2的转化率最低的是(? )
①400 ℃,10 mol SO2和5 mol O2反应
②400 ℃,20 mol SO2和5 mol O2反应
③300 ℃,10 mol SO2和5 mol O2反应
A.①
B.②
C.③
D.无法判断
参考答案:B
本题解析:温度高,v大;SO2与O2的物质的量比值〔n(SO2)∶n(O2)〕越大,SO2转化率越低。
本题难度:一般
5、填空题 (6分)某温度时 ,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
(1)由图中数据分析:该反应的化学方程式为?。
(2)反应开始至2min,用Z表示的平均反应速率为?
(3)判断:第5分钟时,反应是否达到平衡?_______(填“是”或“否”)。第5分钟时,Z的生成速率与Z的消耗速率相比_________(填”大”、“小”或“相等”)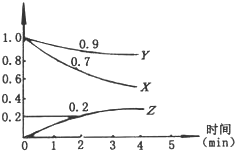
参考答案:(6分)(1)3X+Y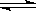 2Z (2分)
2Z (2分)
(2)0.05mol·L-1·min-1; (2分)
(3)?是?相等(2分)
本题解析:略
本题难度:一般