1、选择题 “活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法不正确的是
A.活化分子之间的碰撞一定是有效碰撞
B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
C.对于有气体参加的反应缩小体积,可使单位体积内活化分子增多,反应速率加快
D.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
参考答案:A
本题解析:A项:活化分子之间的碰撞不一定都是有效碰撞,故错。故选A。
点评:本题考查的是活化分子的相关知识,化学反应的发生必须有“活化分子”且发生有效碰撞,“活化分子”越多,反应越快。
本题难度:简单
2、计算题 在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g)  x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比是多少?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
参考答案:(1)0.4mol/(L·min)
(2)反应前后的压强比是5/4.2
(3)80%
(4)19%
本题解析:根据题中信息、物质反应的物质的量之比等于化学计量数之比和化学方程式列出“三行式”,
2M(g)+ 3N(g)? ?x Q(g)+3R(g)
?x Q(g)+3R(g)
开始的物质的量 2mol? 3mol? 0? 0
反应的物质的量 1.6mol? 2.4mol?0.4mol/L×2L? 2.4mol
2min后物质的量 0.4mol? 0.6mol? 0.8mol? 2.4mol
根据物质的量之比等于化学计量数之比,x=1。
(1)v(M)= △c(M)÷t=△n(M)÷V÷t=1.6mol÷2L÷2min=0.4mol/(L·min)。
(2)根据压强之比等于物质的量之比,故反应前后的压强比是(2mol+3mol)/( 0.4mol+0.6mol+0.8mol+2.4mol)=5/4.2。
(3) N的转化率是2.4mol÷3mol×100%=80%。
(4) 平衡时气体Q所占的体积分数为0.8mol÷( 0.4mol+0.6mol+0.8mol+2.4mol)×100%=19%。
本题难度:一般
3、填空题 (5分)⑴课本设计了如图一所示实验,其目的是通过比较H2O2的分解速率来比较 ,可通过观察 来定性比 较。有同学提出将CuSO4改为CuCl2更为合理,其理由是 。
较。有同学提出将CuSO4改为CuCl2更为合理,其理由是 。
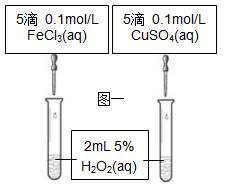
⑵已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____ 的影响。②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_____
A.硫酸钾
B.硫酸锰
C.水
D.氯化锰