1、填空题 已知:H2(g)+ 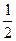 O 2(g)====H2O(g),反应过程中能量变化如下图,问:
O 2(g)====H2O(g),反应过程中能量变化如下图,问:
(1)a、b、c分别代表什么意义?
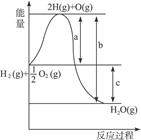
a._____________________________________________________________________________;
b._____________________________________________________________________________;
c.
_____________________________________________________________________________。
(2)该反应是放热还是吸热?___________。ΔH大于零还是小于零?___________。
参考答案:(1)a:H2分裂为H,O2分裂为O时吸收的热量b:H、O结合生成H2O放出的热量? c:该反应放出的热量
(2)放热 ΔH<0
本题解析:化学反应是旧键断裂(吸热),新键生成(放热)的过程。该反应是吸热还是放热要看这两个过程的相对大小。
本题难度:简单
2、选择题 将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)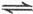 C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
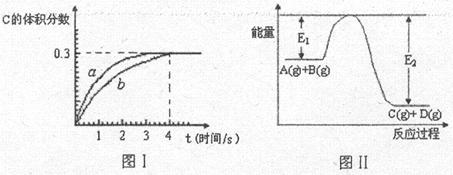
A. 在上述反应体系中加入催化剂,化学反应速率增大,E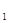 和E
和E 均减小
均减小
B. 该温度下,反应的平衡常数数值约为7.36;若升高温度,该反应的平衡常数减小
C. 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行
D. 反应在第4秒钟达到化学平衡状态,此时以A表示的速率是v(A)=0.225mol·L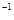 ·s
·s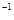
参考答案:D
本题解析:催化剂只能改变活化能不能改变反应热,A正确;从图I可知平衡时C的物质的量为0.9mol,则D为0.9mol,A为0.1mol,B为1.1mol,所以K=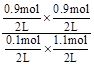 =7.36,从图II可知,该反应为放热反应,升高温度平衡常数减小,B正确;给反应前后气体的体积不变,所以缩小容器的体积只加快反应速率不改变平衡,C正确;4s时A为0.1mol,则v(A)=
=7.36,从图II可知,该反应为放热反应,升高温度平衡常数减小,B正确;给反应前后气体的体积不变,所以缩小容器的体积只加快反应速率不改变平衡,C正确;4s时A为0.1mol,则v(A)=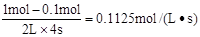 ,D错误。答案选D。
,D错误。答案选D。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
3、选择题 下列叙述正确的是
A.物质燃烧都是吸热反应
B.化学反应总是伴随着能量的变化
C.化学反应中需要加热的反应一定是吸热反应
D.化学反应中放出的热量就是反应热
参考答案:B
本题解析:A:燃烧均为放热反应
B:正确
C:加热是反应条件,而吸热反应是指反应物的总能量低于生成物的总能量的化学反应,两者没有直接的关系,不正确
D:无论放热或吸热均为反应热
答案为B
本题难度:一般
4、选择题 下列反应中属于放热反应的是()
①.碳酸钙受热分解②乙醇燃烧③铝粉与氧化铁粉末反应④氢氧化钠溶于水
⑤锌与盐酸反应⑥碳与二氧化碳反应
A.②③④⑤⑥
B.①②③④⑤
C.②③④⑤
D.②③⑤
参考答案:D
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,所以答案选D。
本题难度:简单
5、选择题 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:
①Sn(白,s)+2HCl(aq)===SnCl2(aq)+H2(g)? ΔH1
②Sn(灰,s)+2HCl(aq)===SnCl2(aq)+H2(g)? ΔH2
③Sn(灰,s) 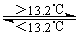 Sn(白,s)ΔH3=+2.1 kJ·mol-1
Sn(白,s)ΔH3=+2.1 kJ·mol-1
下列说法正确的是?
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏
参考答案:D
本题解析:A、方程式②和①相减可得灰锡转化为白锡的方程式③,ΔH3=ΔH2-ΔH1>0,故 ΔH2大于ΔH1,故A错误;B、大于13.2℃时,灰锡转化为白锡,故B错误;C、由方程式③可知灰锡转化为白锡为吸热反应,故C错误;D、低于13.2 ℃的环境中,白锡转化为粉末状的灰锡,故会自行毁坏,D正确;故选D。
本题难度:一般