1、选择题 下列过程中△H大于零的是?(?)
A.乙醇燃烧
B.酸碱中和反应
C.碳酸钙分解得二氧化碳
D.实验室制备氢气
参考答案:C
本题解析:A乙醇燃烧是放热反应,△H小于零
B酸碱中和反应是放热反应,△H小于零
C.碳酸钙分解得二氧化碳是吸热反应,△H大于零
D. 实验室制备氢气是放热反应,△H小于零。
本题难度:简单
2、选择题 下列各图象中,不正确的是( )
A.
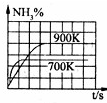
N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ/mol
B.

向弱酸HA的稀溶液中加水稀释
C.
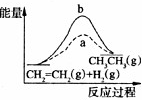
有催化剂(a)和无催化剂(b)时反应的能量变化
D.
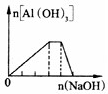
向NH4Al(SO4)2溶液中滴加过量NaOH溶液
参考答案:A、温度升高,反应速率增大,到达平衡用的时间少,反应曲线的斜率大,并且该反应为放热反应,升高温度平衡向逆反应方向移动,氨气的含量降低,故A错误;
B、向弱酸HA的稀溶液中加水稀释,促进弱酸的电离,平衡向正反应方向移动,则n(A-)增加,n(HA)减少,根据
c(A-)c(HA)=n(A-)n(HA)可知加水稀释时c(A-)c(HA)增大,故B正确;
C、催化剂降低反应的活化能,故C正确;
D、向NH4Al(SO4)2溶液中滴加过量NaOH溶液,首先发生反应为Al3++3OH-═Al(OH)3,当沉淀完全时,NH4+与OH-离子发生反应:NH4++OH-═NH3?H2O,此时沉淀的质量不变,继续加NaOH,之后Al(OH)3继续与OH-离子反应:Al(OH)3+OH-═AlO2-+2H2O,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 下列说法中错误的是
[? ]
A.化学反应中的能量变化通常表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热
参考答案:B
本题解析:
本题难度:简单
4、简答题 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式______;
(2)PCl5分解生成PCl3和Cl2的热化学方程式______;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol?PCl5,反应达到平衡时还剩余0.6mol?PCl5,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2______α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______;
(4)P和Cl2分两步反应生成1mol?PCl5的△H3=______;P和Cl2一步反应生成1mol?PCl5的△H4______△H3(填“大于”、“小于”或“等于”),原因是______.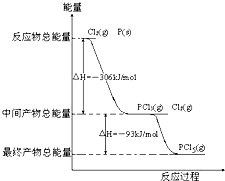
参考答案:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为P(s)+32Cl2(g)═PCl3(g);△H=-306 kJ/mol,
即2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol,故答案为:2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol;?
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式为PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,PCl5分解率α1=0.8-0.60.8×100%=25%.PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;25%;大于;?
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成;
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
2P(s)+3Cl2(g)=PCl3(g);△H1=-612 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,根据盖斯定律:化学反应不管是一步完成,还是分步完成,化学反应的焓变是一样的,
故答案为:-399kJ/mol;等于;根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.
本题解析:
本题难度:一般
5、选择题 下列热化学方程式正确的是( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.C(g)+O2(g)=CO(g) ΔH=393.5 kJ·mol-1
C.H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ
O2(g)=H2O(g) ΔH=-241.8 kJ
D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
参考答案:D
本题解析:A、未写出物质的聚集状态,错误;B、ΔH未标明“+”“-”号,不能判断反应为吸热还是放热反应,错误;C、反应热的单位是kJ/mol,错误;D、符合热化学方程式的书写,正确,答案选D。
本题难度:一般