1、选择题 由X、Y两元素组成的气态化合物XY4,在一定条件下完全分解为A、B两种气体物质,己知标准状况下20mLXY4分解可产生标准状况下30mL A气体(化学式为Y2)和10mL B气体,则B的化学式为
A.X2 B.Y2X2 C.XY2 D.X2Y4
参考答案:B
本题解析:根据题意可写出化学方程式可写成2XY4=3Y2+B根据质量守恒定律,反应前后原子个数不变,B的 化学式为Y2X2,答案选B
考点:质量守恒定律及应用
本题难度:一般
2、计算题 (4分)现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度为_________
(2)将此浓盐酸用蒸馏水稀释至200mL,则稀释后溶液中Cl-的物质的量浓度与______ mol/L的氯化镁溶液中的Cl-浓度相同。
参考答案:(1)11.8mol/L;(2)1.475
本题解析:(1)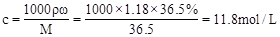
(2)稀释后c(Cl-)=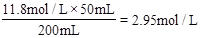 。一个MgCl2中有2个Cl-,所以与该盐酸中Cl-的物质的量浓度相等的MgCl2的浓度为1.475 mol/L。
。一个MgCl2中有2个Cl-,所以与该盐酸中Cl-的物质的量浓度相等的MgCl2的浓度为1.475 mol/L。
点评:本题基础简单,主要根据两种浓度的转换公式和稀释公式来计算。
本题难度:一般
3、填空题 某同学用12.5 mol/L浓硝酸来配制500 mL1 mol/L的稀硝酸,并进行有关实验。请回答有关问题:
(1)需要量取12.5 mol/L的浓HNO3________mL,配制该稀硝酸时使用的仪器除量筒、玻璃棒、烧杯外,还必须用到的仪器有______、___________等。
(2)取所配制的稀HNO3200 mL,与一定质量的铜粉充分反应,铜粉全部溶解后,生成的唯一还原产物NO气体在标况下的体积为0.56L。则:写出Cu与稀HNO3反应的化学方程式 ,参加反应的铜粉的质量为_________g。
(3)若要将溶液中Cu2+全部转化为Cu(OH)2沉淀,至少需加入0.2mol/L的NaOH溶液的体积为 ml.
(注:要求在答题卡最下面方框内仅列出计算比例式)
参考答案:(1)40 mL (2分)500mL容量瓶 (2分)胶头滴管 (2分)
(2)3Cu+8HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O ,2.4g(4分);
(3) 875ml.(4分)
本题解析:(1)稀释前后溶质的物质的量不变 0.5L×1mol/L=VL×12.5mol/L 所以V=0.04L,既是40ml ,(2)根据方程式中铜和一氧化氮的物质的量之比是3:2,mcu="0.56L/22.4L/mol" ×3/2 ×64g/mol=2.4g (3)根据氮元素守恒,0.2L 1mol/L 既是0.2mol 所以 nNaOH=nNaNO3=0.2mol-nNO=0.175mol 所以VL=n/c=0.175mol/0.2mol/L=0.875L
考点:本题考查了一定物质的量浓度溶液的配制,化学反应方程式的书写及相关物质的量的计算。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列说法正确的是
A.18gD2O中含有的电子数是10NA
B.1molBaCl2中含有的离子数是2NA
C.7.1gCl2与足量的NaOH溶液反应转移的电子数是0.2NA
D.1molCH4分子中共价键总数是4NA