1、选择题 amolFeS与bmolFe3O4投入到VL?cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
[? ]
A.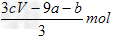 ?
?
B.(a+3b)mol?
C.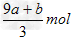 ?
?
D.(cV-3a-9b)mol
参考答案:A
本题解析:
本题难度:一般
2、选择题 工业上用碳还原SiO2制取单质硅会发生如下副反应:SiO2+3C==SiC+2CO↑.该反应中氧化剂与还原剂的质量比为
A.36∶60
B.60∶36
C.1∶2
D.1∶3
参考答案:C
本题解析:
本题难度:简单
3、计算题 某人设想以下图所示(含有某种催化剂的)装置用电化学原理生产硫酸
(1)写出通入SO2的电极的电极反应式
(2)若通入SO2的速率为2.24 L/min(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,求左侧水的流入速率(结果用mL/min表示)

参考答案:(1)SO2+2H2O-2e-=SO42-+4H+
(2)13.4 mL/min
本题解析:
本题难度:一般
4、选择题 在3Cl2+6KOH=KClO3+5KCl+3H2O中,还原产物和氧化产物的物质的量之比为
A.1∶5
B.1∶3
C.5∶1
D.3∶1
参考答案:C
本题解析:
本题难度:简单
5、选择题 已知浓H2SO4和Fe3+都可以将Cu氧化成Cu2+,浓H2SO4也可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3.由此可以确定上述有关物质氧化性由强到弱的顺序为
A.浓
B.浓
C.Br2>浓
D.Fe3+>Cu2+>Br2>浓H2SO4
参考答案:A
本题解析:分析:在自发进行的氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,据此分析解答.
解答:浓H2SO4和Fe3+都可以将Cu氧化成Cu2+,反应中,浓硫酸和铁离子是氧化剂,铜离子是氧化产物,所以浓硫酸和铁离子的氧化性大于铜离子;
浓H2SO4也可以将Br-氧化成Br2,该反应中浓硫酸是氧化剂,溴是氧化产物,所以浓硫酸的氧化性大于溴;
Fe与Br2反应生成FeBr3,该反应中溴是氧化剂,铁离子是氧化产物,所以溴的氧化性大于铁离子,
根据以上分析知,氧化性强弱顺序是:浓H2SO4>Br2>Fe3+>Cu2+,故选A.
点评:本题考查了氧化性强弱的判断,正确判断反应中氧化剂和氧化产物是解本题关键,难度不大.
本题难度:简单