1、选择题 下列分子的中心原子采取SP杂化的是 (?)
A.XeO4
B.BeCl2
C.CH4
D.PCl3
参考答案:B
本题解析:直线形为SP杂化,平面三角形为SP2杂化,正四面体为SP3杂化。XeO4的分子构型?为正方体,BeCl2?直线形? CH4 正四面体?、PCl3三角锥形
本题难度:简单
2、选择题 电子在一个原子的下列能级的原子轨道中排布时,最后排布的是
A.np
B. ns
C.(n-1)d
D.(n-2)f
参考答案:A
本题解析:由构造原理可知,np能级的能量最高,所以最后填入的一定是np轨道,答案选A。
本题难度:一般
3、选择题 下列物质中属于纯净物的是
A.漂白粉
B.食盐水
C.碘酒
D.硫酸铜
参考答案:D
本题解析:
本题难度:简单
4、填空题 硅、铝和铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)Al的原子结构示意图为 ? ;Al与NaOH溶液反应的离子方程式为
? 。
(2)30Si原子的中子数为 ? ,Si的晶体类型为 。
(3)Al3+与Yn—的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 ? 。
(4)某焊药熔渣36.0g(含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体。则此熔渣中Al2O3的质量分数为
。
参考答案:(1)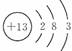 ,2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑
,2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑
(2) 16 原子晶体? (3) HCl?(4)25%
本题解析:(1)Al是13号元素,所以Al的原子结构示意图为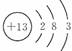 ;Al与NaOH溶液反应的离子方程式为2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑。
;Al与NaOH溶液反应的离子方程式为2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑。
(2)中子数和质子数之和是质量数,30Si原子的中子数为30-14=16。Si的结构与金刚石相似,所以晶体类型为原子晶体。
(3)Al3+与Yn—的电子数相同,所以Y是第二周期的元素。Y所在族各元素的氢化物的水溶液均显酸性,所以是第ⅦA族元素。由于HF分子间存在氢键,所以该族氢化物中沸点最低的是HCl。
(4)二氧化硅与盐酸不反应,所以11.0g固体是二氧化硅。氢氧化铝是两性氢氧化物,能溶解再氢氧化钠溶液中,因此得到的21.4g固体是氢氧化铁,物质的量是0.2mol没声音根据铁原子守恒可知,氧化铁的物质的量是0.1mol,质量是16g,则氧化铝的质量是36.0g-16g-11.0g=9g,因此氧化铝的质量分数是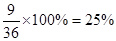 。
。
点评:固体是高考中的常见题型,属于基础性试题的考查,难度不大。主要是对学生基础性知识的巩固与检验,同时兼顾对学生能力的培养,有利于培养学生的应试能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
5、填空题 现有A、B、C、D、E六种元素原子序数依次增大;只有E不是短周期元素;对其分别描述如下表:
元素编号
| 元素描述
|
A
| 单质是最理想的气体燃料;而氧化物是最常用的液态灭火剂
|
B
| 氧化物之一不但能造成酸雨,还能造成光化学烟雾
|
C
| 所处周期数、族序数都与电子层数相等
|
D
| 最高化合价为+7
|
E
| 目前用量最大,应用最广泛的金属
|
?
(1)元素D的最高价氧化物为无色液体, 0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式?;
(2)用一个化学方程式表示C与E的金属性强弱?。
(3)A与B两种元素组成一种阳离子,检验某溶液中含有该离子的方法是?。
(4)含C的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是?。(用离子方程式表示)
(5)E单质在海水中易被腐蚀,写出正极反应式:?。
参考答案:(1)C12O7(l)+H2O(1)=2HClO4(aq);△H=-4Q kJ·mol-1(2分)
(2)2Al+Fe2O3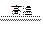 Al2O3+2Fe(2分,其他合理答案也给分)
Al2O3+2Fe(2分,其他合理答案也给分)
(3)取少量的溶液于试管中,滴加浓氢氧化钠溶液,微热,将湿润的红色石蕊试纸置于试管口,试纸变蓝。(2分)
(4)Al3++3H2O Al(OH)3+3H+(2分)?
Al(OH)3+3H+(2分)?
(5)2H2O+O2+4e-=4OH-(2分)
本题解析:略
本题难度:一般