1、填空题 氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法。
(1)氯化铝融盐电解法需要先制纯氧化铝。以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料通过以下途径提纯氧化铝:

①依次写出X、Y的成分?,??。
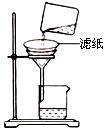
②如图所示在实验室中进行过滤,操作中的两处错误分别是?;?。
(2)制备无水氯化铝的反应为:2Al2O3+6Cl2 4AlCl3+3O2
4AlCl3+3O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是?。
④加入焦炭后的化学反应可表示为Al2O3+C+Cl2 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断)?,请说明理由?。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断)?,请说明理由?。
(3)现在工业上通常用电解熔融氧化铝方式制取铝,理论上生产1吨铝消耗的氧化铝的质量_________
(填“大于”、“小于”、“等于”)氯化铝质量。
参考答案:(10分)(1)①NaOH溶液(1分);?稀盐酸(1分)
②没有使用玻璃棒引流;滤纸边缘高于漏斗边缘(2分)
(2)③碳与O2反应,有利于反应正向进行(2分)
④不正确。将生成气体先通过灼热的CuO粉末,若有CO就会生成CO2,这样就无法确定原来是否有CO2。(2分)?(3)小于(2分)
本题解析:(1)①滤液乙能和氨水反应生成氢氧化铝沉淀,这说明滤液乙中含有铝离子,所以Y应该是盐酸。则滤液甲中含有AlO2-和SiO32-,因此X是NaOH。氧化铁和氢氧化钠不反应,过量得到氧化铁。硅酸钠和盐酸反应生成硅酸沉淀,过量得到氯化铝和盐酸的混合液,加入氨气即生成氢氧化铝沉淀。
②根据装置图可知,该装置是过滤装置,因此主要的错误在于没有使用玻璃棒引流,其次滤纸边缘高于漏斗边缘。
(2)③因为在加热的条件下,碳与O2反应,生成CO或CO2,降低氧气的浓度,有利于反应正向进行。
④由于在加热的条件下,CO能和氧化铜反应生成CO2,所以将生成气体先通过灼热的CuO粉末,若有CO就会生成CO2,这样就无法确定原来是否有CO2,所以是不正确的。
(3)根据原子守恒可知,1mol氧化铝可以生成2mol氯化铝。1mol氧化铝的质量是102g,2mol氯化铝的质量是2mol×133.5g/mol=267g,所以氧化铝的质量小于氯化铝的质量。
本题难度:一般
2、选择题 以氧化铝为原料制取氢氧化铝,最好的方法是
[? ]
A.将氧化铝溶于水
B.将氧化铝先溶于盐酸中,之后滴加氨水
C.将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液
D.将氧化铝溶于氢氧化钾
参考答案:B
本题解析:
本题难度:简单
3、计算题 有铝和四氧化三铁组成的铝热剂粉末,在隔绝空气中的条件下引燃,使之充分反应,把所得混合物研细,并分成两等份,分别投入到过量烧碱溶液和盐酸中,充分反应后,前者消耗氢氧化钠mmol,放出标准状况下的气体0.672L;后者消耗盐酸nmol,放出标准状况下气体VL。若将等质量的这种铝热剂中的铝粉和足量的稀硫酸反应,可以得到标准状况下的气体6.72L。
(1)铝热剂中各成分的质量分数。
(2)m、n、V的值各是多少?
参考答案:(1)
Fe3O4%=1-27.95%=72.05%
(2) m=0.10(mol)
N =0.48(mol)
V =2.688(L)
本题解析:题目没有指明铝热剂中铝粉和四氧化三铁各自的质量分数,那么铝粉和四氧化三铁混合有三种情况:①铝粉和四氧化三铁适量,恰好两者完全反应,反应物无剩余,产物是三氧化二铝和单质铁,该混合物投入过量的氢氧化钠溶液中,铁跟氢氧化钠溶液不反应,三氧化二铝跟氢氧化钠溶液反应,但是不放出气体,不合题意;②铝热剂中四氧化二铁过量,反应后的混合物中有三氧化二铝、铁和剩余的四氧化三铁,将其混合物投入过量的氢氧化钠溶液中,铁和四氧化三铁跟氢氧化钠溶液都不反应,三氧化二铝跟氢氧化钠反应,但是不放出气体,不合题意;③铝热剂中铝粉过量,反应后混合物中有三氧化二铝和剩余的铝,将其混合物投入过量的氢氧化钠溶液中,铁跟氢氧化钠不反应,三氧化二铝和铝都能跟氢氧化钠溶液反应,而且铝在反应时能够放出氢气,符合题意。
(1)求铝热剂中各成分的质量分数。
设原铝热剂中含xg。
2Al+3H2SO4=Al2(SO4)3+3H2↑
2×27g?3×22.4L
xg? 6.72L
2×7∶x=3×22.4∶6.72
解得x=5.4(g)
设铝热反应后剩余的铝为yg。
2Al+2NaOH=2H2O=2NaAlO2+3H2↑
2×27g?3×22.4L
yg? 0.672L
2×27∶y=3×22.4∶0.672
解得? y=0.54(g)
故参加铝热反应的铝粉为5.4-0.54×2=4.32(g)
设铝热剂中四氧化三铁的质量为zg
8Al? +? 3Fe3O4?→? 4Al2O3?+? 9Fe
8×27g?3×232? 4mol? 9mol
4.32g?zg? b="0.08mol?" c=0.18mol
8×27∶4.32=3×232∶z
解得z=13.92(g)

Fe3O4%=1-27.95%=72.05%
(2)求m、n和V
反应后每份反应后的混合物含铝0.54g,含铁0.18/2=0.09(mol)含三氧化二铝0.08/2=0.04(mol)
Al2O3?+? 2NaOH=2NaAlO2+H2O
1mol? 2mol
0.04mol? 0.08mol
所以m=0.02+0.08=0.10(mol)
2Al? +? 6HCl = 2AlCl3?+? 3H2↑
2×27g?6mol? 3×22.4L
0.54g?0.06mol? 0.672L
Fe? +? 2HCl? ="?" FeCl2?+? H2↑
1mol? 2mol? 22.4L
0.09mol? 0.18mol? 22.4×0.09L
Al2O3?+? 6HCl=2AlCl3+3H2O
1mol? 6mol
0.04mol? 6×0.04mol
所以n=0.06+0.18+0.24=0.48(mol)
V=0.672+22.4×0.09=2.688(L)
FM
本题难度:一般
4、选择题 已知室温下,Al(OH)3的Ksp远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是(? )
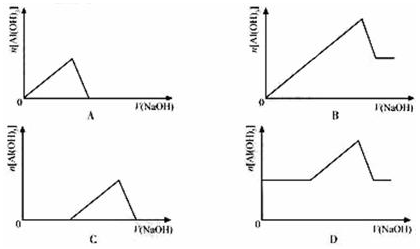
参考答案:C
本题解析:室温下,Al(OH)3的Ksp远大于Fe(OH)3,Al(OH)3的溶解度大,所以加入NaOH先生成Fe(OH)3沉淀,Fe(NO3)3完全沉淀后再和Al(NO3)3反应生成Al(OH)3,继续滴加NaOH沉淀溶解。所以图像选C。
本题难度:一般
5、选择题 区别镁和铝最好的方法是:取少量试样,然后?(?)
A.投入沸水中
B.投入冷水中
C.投入盐酸中
D.投入NaOH溶
参考答案:D
本题解析:铝既能与强碱反应又能与强酸反应,而镁不能与碱反应;
本题难度:简单