1、填空题 下图每一方框中的字母代表一种反应物或生成物:产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:?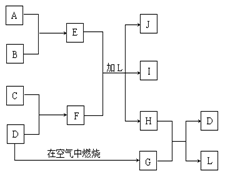
(1)L的化学式为:?。
(2)F的化学式为:?。
(3)写出J受热分解反应的化学方程式:?。
(4)E的溶液呈酸性的原因(用离子方程式表示) ________________________。
(5)H和G之间反应的化学方程式为:________________________________?。
参考答案:(1)H2O
(2)Na2S
(3)2Al(OH)3=Al2O3+3H2O
(4)Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(5)2H2S+SO2=3S+2H2O
本题解析:由所给信息可知淡黄色固体单质D为硫,在空气中燃烧生成G为SO2,而能与SO2生成D(硫)的反应为:2H2S+SO2=3S+2H2O,进而可知H为H2S,L为H2O
白色胶状沉淀J为Al(OH)3,I为NaCl溶液,A为铝单质,很明显铝的化合物E与硫的化合物F与L发生了双水解,生成了Al(OH)3、NaCl、H2S,可知F为Na2S,而E为AlCl3
本题难度:一般
2、选择题 新买的铝锅、铝壶用来烧开水时,凡是水浸到的地方都会变成黑色,这与水中含有下列哪种可溶性盐有关
[? ]
A.钠盐
B.钾盐
C.钙盐
D.铁盐
参考答案:D
本题解析:
本题难度:简单
3、选择题 甲、乙两烧杯中分别盛有10mL?1mol?L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水.下列有关两个烧杯的说法中,正确的是
A.甲中产生的沉淀一定比乙中多
B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多
D.甲和乙中产生的沉淀可能一样多
参考答案:D
本题解析:分析:根据氢氧化铝的性质,其能溶于氢氧化钠但不溶于氨水,故开始加入时,两烧杯中生成的都是氢氧化铝沉淀;
相同体积、相同pH的两溶液中的溶质一水合氨大于氢氧化钠:
当两者均不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠恰好时,生成的沉淀一样多;
氨水和氢氧化钠都过量时,生成的沉淀氨水多.
解答:因氨水和NaOH溶液中,各加入10mL?0.1mol?L-1?AlCl3溶液,生成氢氧化铝沉淀,但氨水为弱电解质,部分电离,氢氧化钠为强电解质,完全电离,相同体积、相同pH的氨水和NaOH溶液中的溶质一水合氨的物质的量大于氢氧化钠的物质的量;
当两者都不足量时,生成的氢氧化铝沉淀的量由一水合氨和氢氧化钠来决定,一水合氨的物质的量大于氢氧化钠的物质的量,所以甲中沉淀比乙中的少;
?当氨水过量,氢氧化钠不足时,乙中生成的氢氧化铝的物质的量为10mL×10-3L/mL×0.1mol?L-1=0.001mol,甲中生成的氢氧化铝的物质的量小于0.001mol,所以甲中沉淀比乙中少;
当氨水过量,氢氧化钠恰好时,生成的沉淀取决于氯化铝,氯化铝的量相等,所以甲和乙中生成的沉淀一样多;
当氨水和氢氧化钠都过量时,因氢氧化铝能溶于氢氧化钠但不溶于氨水,乙中生成的氢氧化铝为0.001mol,甲中生成的氢氧化铝溶于过量的氢氧化钠,氢氧化铝沉淀小于0.001mol,所以甲中沉淀比乙中少.
通过以上分析知,甲中沉淀少于或等于乙中沉淀,故ABC错误、D正确;
故选D.
点评:本题考查了铝化合物性质、化学计算等,此题解答时,根据氢氧化铝的性质采用讨论的方法进行解答,能正确进行分段是解本题的关键,难度较大.
本题难度:一般
4、选择题 下列叙述正确的是( )
A.硅元素在自然界中以游离态存在
B.氨气是工业制取硝酸的重要原料
C.铝是金属,与强碱不能发生反应
D.陶瓷、玻璃、水泥都属于碳酸盐产品
参考答案:A、Si在自然界中的存在既有单质硅又有含硅的化合物,所以既有游离态又有化合态,故A错误;
B、氨气催化氧化可以获得一氧化氮,然后转化为二氧化氮,和水反应可以获得硝酸,氨气是工业制取硝酸的重要原料,故B正确;
C、金属铝既能和强酸反应又能和强碱反应,故C错误;
D、陶瓷、玻璃、水泥的主要成分中均含有硅酸盐,属于硅酸盐产品,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 常温下,能用铝制品容器盛装的药品是
A.浓硫酸
B.浓盐酸
C.稀硝酸
D.硫酸铜溶液
参考答案:A
本题解析:分析:常温下用铝制品容器盛装的药品是不能与铝反应,或常温下发生钝化现象阻止反应进行.
解答:A、常温下,铝在浓硫酸中发生钝化现象,表面生成一层致密氧化物薄膜阻止反应进行,可以用铝制品容器盛装,故A正确;
B、常温下,浓盐酸和铝反应,不能用铝制品容器盛装,故B错误;
C、常温下稀硝酸和铝反应,不能用铝制品容器盛装,故C错误
D、常温下硫酸铜和铝反应,不能用铝制品容器盛装,故D错误;
故选A.
点评:本题考查了铝、浓硫酸、浓盐酸、稀硝酸、的性质应用,较简单,掌握钝化现象的实质是解题关键.
本题难度:困难