| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《原电池原理》高频试题强化练习(2020年最新版)(八)
 (3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量.写出其完全燃烧的热化学方程式: 。 (4)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验: 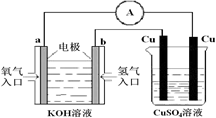 上图装置中,某一铜电极的质量减轻 6.4g ,则 a 极上消耗的O2在标准状况下的体积为 L。 参考答案:(1) C; (2) b;吸热;(3) 2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ/mol; (4) 1.12L 。 本题解析:A.电解水消耗大量的电能,不经济,错误;B.锌和稀硫酸反应,由于Zn的热还原法冶炼,硫酸是化工试剂,制取成本较高,在制取过程中会产生大气污染,不安全,错误;C.光解海水,海水原料来源广泛,太阳光也充足,成本低,安全系数大,正确;D.分解天然气,消耗大量的化石能源,还消耗大量的其它能源,成本高,不经济,错误;(2)由于催化剂能够降低反应的活化能,使反应在较低的温度下进行,反应速率大大加快,所以表示使用催化剂是曲线是b;因为生成物的总能量高于反应物的总能量,所以该反应是吸热反应;(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量,则其完全燃烧的热化学方程式是:2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ/mol;(4)在同一闭合电路中电子转移的数目相等。n(Cu)=6.4g÷64g/mol=0.1mol,Cu是+2价的金属,所以n(e-)=0.2mol。由于每1mol的O2反应转移电子4mol,所以若只有0.2mol的电子,则反应消耗氧气的物质的量是0.2mol÷4=0.05mol,在标准状况下,体积是V=0.05mol×22.4L/mol=1.12L。 本题难度:困难 3、选择题 下列有关电化学知识的描述正确的是 参考答案:D 本题解析: 本题难度:一般 4、选择题 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是(?) 参考答案:C 本题解析:甲是电解池,乙是原电池。对于甲,在阳极发生反应4OH—-4e-= O2↑+2H2O当电路中通过的电子是0.1mol时,产生气体0.025mol.对于乙:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若转移电子0.1mol,则产生气体的物质的量为0.05mol,因此相同条件下产生气体的体积V甲<V乙。错误。B.对于甲,反应的总方程式为:2CuSO4+2H2O 本题难度:一般 5、填空题 (7分)“阿波罗号飞船”所用的氢氧燃料电池的电极应为:负极:2H2+4OH--4e-=4H2O,则正极反应为?;该电池工作时,通氢气的一极发生?反应(填氧化、还原),每转移4摩电子,电池内增加?摩水,负极附近溶液的PH值?,(填升高、降低、不变),正极附近? [H+]?(填升高、降低、不变) 参考答案:(7分) 本题解析:略 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《溶液和胶体.. | |