1、选择题 在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3;⑤HCl;⑥H2O2;铜粉可溶解的是
A.①②⑤
B.①④⑥
C.②③⑤
D.②④⑥
参考答案:D
本题解析:分析:根据铜的化学性质,如:铜不能与非氧化性酸反应,但可以和氧化性酸反应,能与具有氧化性的FeCl3溶液、酸性溶液中的H2O2、酸性条件下硝酸盐等反应
解答:①因铜不如铁活泼,则铜不能与FeCl2反应,故①错误;
②因Fe2O3能与稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu=2FeSO4+CuSO4,铜粉溶解,故②正确;
③Zn、Cu、H2SO4形成原电池,加快了反应,但发生的化学反应为Zn+H2SO4=ZnSO4+H2↑,Zn溶解,故③错误;
④根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故④正确;
⑤加入盐酸铜和元素、稀硫酸都不能反应,故④错误;
⑥过氧化氢是氧化剂在酸性溶液中可以氧化铜,Cu+H2SO4+H2O2=CuSO4+2H2O,故⑥正确;
故选D.
点评:本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐.
本题难度:困难
2、选择题 下列工业生产属于物理变化的是
A.海水提溴
B.合成氨
C.接触法制硫酸
D.海水晒盐
参考答案:D
本题解析:分析:物理变化与化学变化的区别在于:原子核不变的情况下,物理变化没有新物质生成,化学变化生成了新物质.
A.根据海水提溴的原理思考;
B.根据合成氨的反应来考虑;
C.根据接触法制硫酸来思考;
D.根据海水晒盐的方法把握.
解答:A.海水提溴时,要用氯气把海水中的溴离子置换成为单质溴,发生的是化学变化,故A错误;
B.工业合成氨是用氢气与氮气在一定温度、一定压强、有催化剂的条件下生成氨气,即发生的是化学反应,故B错误;
C.接触法制硫酸是在沸腾炉中把硫铁矿氧化为二氧化硫,进而氧化为三氧化硫,从而三氧化硫与水反应生成硫酸,发生的是化学变化,故C错误;
D.海水晒盐是通过太阳照射使海水中的水分蒸发而得到食盐,没有新物质生成,故D正确.
故选D.
点评:要根据化学变化和物理变化的区别来分,这要求在学习时要把握某些的概念的区别和联系,进而达到熟练运用的程度.
本题难度:困难
3、选择题 某气态烷烃和气态炔烃的混合烃2L,完全燃烧后生成CO2?2.8L、水蒸气3.2L(同压且同在200℃下测定),该混合烃可能为
A.CH4 C2H2
B.C2H6 C2H2
C.C3H8 C3H4
D.CH4 C3H4
参考答案:A
本题解析:根据原子守恒可知,该混合气的平均分子组成是C1.4H3.2,因为在所有的烃中只有甲烷含有1个碳原子,所以根据平均原理可知,混合气中一定含有甲烷。另一种烃的碳原子数大于2,但氢原子数要小于4,因此符合条件的是选项A。答案选A。
本题难度:一般
4、选择题 分子式为C4H8的烯烃有(考虑顺反异构)
A.2种
B.3种
C.4种
D.5种
参考答案:C
本题解析:分子式为C4H8的烯烃有4种,其对应的结构简式如下图所示:
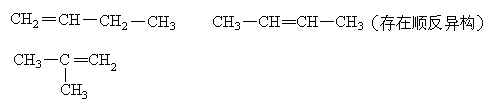
本题难度:简单
5、选择题 能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是
A.Ba(OH)2和NaHSO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O
B.Ba(OH)2和NaHSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
C.Ba(OH)2和KAl(SO4)2:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-
D.Ba(OH)2和KAl(SO4)2:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓
参考答案:BD
本题解析:分析:A.恰好为中性,二者以1:2反应,反应生成硫酸钡、硫酸钠和水;
B.恰好为中性,二者以1:2反应,反应生成硫酸钡、硫酸钠和水;
C.恰好为中性,二者以3:2反应,反应生成硫酸钡、氢氧化铝、硫酸钾;
D.恰好为中性,二者以3:2反应,反应生成硫酸钡、氢氧化铝、硫酸钾.
解答:A.恰好为中性,二者以1:2反应,反应生成硫酸钡、硫酸钠和水,该反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.恰好为中性,二者以1:2反应,反应生成硫酸钡、硫酸钠和水,该反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B正确;
C.恰好为中性,二者以3:2反应,反应生成硫酸钡、氢氧化铝、硫酸钾,该反应的离子反应为3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓,故C错误;
D.恰好为中性,二者以3:2反应,反应生成硫酸钡、氢氧化铝、硫酸钾,该反应的离子反应为3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓,故D正确;
故选BD.
点评:本题考查离子反应方程式的书写,明确反应后溶液为中性来判断反应物的量的关系是解答本题的关键,注意反应的生成物及离子反应的书写方法,题目难度中等.
本题难度:困难