1、选择题 下列用途主要是体现铝的物理性质的是?
①家用铝锅
②盛浓硝酸的容器
③制导线
④焊接钢轨
⑤包装铝箔
⑥炼钢的脱氧剂
⑦做防锈油漆
⑧做合金用作飞机制造业材料
⑨工业做热交换器
A.①②③④
B.⑥⑦⑧⑨
C.①③⑤⑦
D.②④⑥⑧
参考答案:C
本题解析:铝的许多用途都是利用它的物理性质。①、⑨是利用铝的导热性好。②是利用铝的化学性质活泼,和浓硝酸反应生成一层致密的氧化膜,防止进一步跟浓硝酸反应。③铝是良导体。④铝粉和金属氧化物的混合物叫做铝热剂,铝热反应能焊接钢轨,是化学性质。⑤铝的延展性好,能延成铝箔,用做包装。⑥炼钢的最后阶段要用脱氧剂除去过量的氧化亚铁,是化学性质。⑦铝粉银白色,和某些油料混合,制成防锈油漆,涂在铁制品表面,显银白色,既防锈,又干净美观。⑧铝的密度小,制成合金,质轻机械性能好,是汽车、飞机制造业的重要材料。其中①③⑤⑦⑧⑨都是利用铝的物理性质。
本题难度:一般
2、选择题 两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2 L气体,则这种混合物可能是
A.Zn、Al
B.Fe、Zn
C.Al、Mg
D.Mg、Cu
参考答案:A
本题解析:略
本题难度:一般
3、简答题 某中学有甲、乙两个探究性学习小组,他们拟用小颗粒的铝铜合金与足量的稀硫酸反应测定通常状况(约20℃、1.01×105Pa)下的气体摩尔体积(Vm).
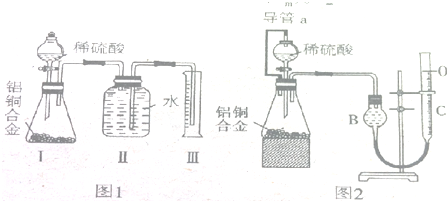
(一)甲组同学拟设计如图1所示的装置来完成实验.
(1)写出装置I中发生反应的离子方程式:______.
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻旋开其活塞,一会儿后发现稀硫酸不能顺利滴入锥形瓶中.请帮助他们分析其原因:______.
(3)实验结束时,生成氢气的体积近似等于:______.
(4)锥形瓶中残存的氢气对实验结果是否有影响:______(填“有”、“没有”、或“不能判断”),简述理由:______.
(二)乙组同学仔细分析了甲组同学的实验装置后以为,稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶中的空气排出,使所测氢气的体积偏大;实验结束后,连接广口瓶
和量筒的导管中有少量水存在,使所测氢气的体积偏小.于是他们设计了如图2所示的实验装置.
(1)装置中导管a的作用是:______.
(2)实验中准确测定出4个数据,如下表:
| 实验前 | 实验后
铝铜合金质量(g)
m1
m2
量液管(C)体积(mL)
V1
V2
|
利用上述数据计算通常状况下的气体摩尔体积:Vm=______.
参考答案:(一)
(1)铝和稀硫酸反应生成硫酸铝和氢气,其离子方程式为:2Al+6H+=2Al3++3H2↑.
故答案为:2Al+6H+=2Al3++3H2↑.
(2)铝与稀硫酸反应产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,所以稀硫酸不能顺利滴入锥形瓶中.
故答案为:铝与稀硫酸反应产生的氢气使锥形瓶内气压增大.
(3)气体产生的压强导致水从集气瓶中排出,且氢气不易溶于水,所以收集到的水的体积近似等于氢气的体积.
故答案为:收集到水的体积近似等于氢气的体积.
(4)装置中有空气存在,生成的氢气不溶于水,在相同温度和压强下,参与氢气的体积与排出空气的体积相等,
所以没有影响.
故答案为:没有、相同温度和压强下,参与氢气的体积与排出空气的体积相等
(二)
(1)铝与稀硫酸反应产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,导管a使锥形瓶内的气体进入分液漏斗上方,使分液漏斗上方的压强增大,稀硫酸顺利滴下.
故答案为:平衡锥形瓶与分液漏斗内的压强,使稀硫酸顺利滴下.
(2)2Al+6H+=2Al3++3H2↑.
? 2mol? 3mol
?
m1-m227mol?(V2-V1)×10-3Vmmol
Vm=9(V2-v1)500(m1-m2)L/mol
?故答案为:9(V2-V1)500(m1-m2)L/mol
本题解析:
本题难度:一般
4、填空题 某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是?。
⑵AlO(OH)与NaOH反应的化学方程式为?。
⑶在稀释、结晶过程中:稀释的目的是?;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的?气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:?。
⑸该生产流程能实现?(填化学式)的循环利用。
参考答案:
⑴加快反应的速率
⑵AlO(OH) +NaOH=NaAlO2+H2O
⑶促进NaAlO2的水解? CO2
⑷Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑸NaOH
本题解析:(1)高温有利于加快反应速率;(2)AlO(OH)与NaOH反应的同样应是偏铝酸钠,AlO(OH) +NaOH=NaAlO2+H2O;(3)该过程是通过NaAlO2的稀释生成Al(OH)3,没有其它反应物,故其应该是水解产生,稀释促进NaAlO2的水解,也可以用CO2与其反应利用强酸制弱酸生成氢氧化铝;(4)加入熟石灰生成碳酸钙除去;(5)NaOH碱浸时使用,最后过滤时产生,故是循环利用。
本题难度:一般
5、选择题 将一定量的Mg和MgO的混合物投入100mL2mol/L的稀盐酸中,完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是
A.100mL
B.50mL
C.25mL
D.无法判断
参考答案:B
本题解析:
氢氧化钠溶液,首先中和剩余的盐酸,然后才能沉淀镁离子,当加入的氢氧化钠使镁离子恰好沉淀,所需的氢氧化钠溶液体积最小,此时最后溶液为氯化钠溶液.根据氯离子守恒可知n(NaCl)=n(HCl)=0.1L×2mol·L-1=0.2mol,根据钠离子守恒可知n(NaOH)=n(NaCl)=0.2mol,所以需4mol·L-1的NaOH溶液的最小体积为0.2mol/4mol·L-1=0.05L=50ml.选B.
本题难度:一般