1、选择题 有100mL3mol?L-1NaOH溶液和100mL1mol?L-1AlCl3溶液按如下两种方法进行实验:①将NaOH溶液逐渐滴加到AlCl3溶液中;②将AlCl3溶液逐渐滴加到NaOH溶液中。比较两次实验的结果是?(?)
A.现象相同,沉淀量相等
B.现象不同,沉淀量相等
C.现象相同,沉淀量不等
D.现象不同,沉淀量不等
参考答案:B
本题解析:略
本题难度:一般
2、选择题 将5.1g镁铝合金投入到500mL 2 mol/L的盐酸中,金属完全溶解,再加入250mL的NaOH溶液,若要使生成的沉淀最多,则应加入的这种NaOH溶液的物质的量浓度是( )
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
参考答案:D
本题解析:略
本题难度:一般
3、选择题 在相同的条件下,下列金属与稀盐酸反应速率最快的是
[? ]
A.铁
B.镁
C.铝
D.铜
参考答案:B
本题解析:
本题难度:简单
4、填空题 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
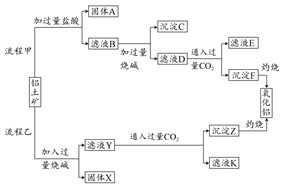
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为?。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为?。
(3)验证滤液B含Fe3+,可取少量滤液并加入?(填试剂名称)。
(4)滤液E、K中溶质的主要成分是?(填化学式),写出该溶质的一种用途:?。
(5)已在298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=?。
参考答案:(1)Al2O3+6H+=2Al3++3H2O (2)SiO2+2OH-=SiO32-+H2O (3)硫氰化钾(或苯酚溶液等合理答案) (4)NaHCO3;制纯碱(或做发酵粉等合理答案)(5)5.6×10-10 mol·L-1
本题解析:本题考查从铝土矿中提取氧化铝的工艺流程。铝土矿中的成分能与HCl反应的有Al2O3、Fe2O3、MgO,不反应的是SiO2,所以固体A为SiO2,滤液B中有Al3+、Fe3+、Mg2+,再加入过量烧碱,Al3++4OH-=[Al(OH)4]-,Fe3++3OH-=Fe(OH)3↓,Mg2++2OH-=Mg(OH)2↓,沉淀C为Fe(OH)3、Mg(OH)2的混合物,滤液D中为Na[Al(OH)4]、NaOH(过量),Na[Al(OH)4]能与CO2反应,Na[Al(OH)4]+CO2(过量)=Al(OH)3↓+NaHCO3,故滤液E为NaHCO3,沉淀F为Al(OH)3,Al(OH)3灼烧得到Al2O3。铝土矿中能与NaOH溶液反应的有Al2O3、SiO2,所以固体X为Fe2O3、MgO,Al2O3+2NaOH+3H2O=2Na[Al(OH)4],SiO2+2NaOH=Na2SiO3+H2O。(5)中应用Ksp的有关计算,Ksp=c(Mg2+)·c2(OH-),c(OH-)=1.0×10-1 mol·L-1,所以c(Mg2+)=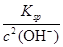 =
=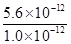 =5.6×10-10(mol·L-1)。
=5.6×10-10(mol·L-1)。
本题难度:一般
5、选择题 由铝硅两种物质组成的试样11 g,均匀地分成等质量的两份,一份与足量的盐酸反应可产生气体a L,一份与足量的NaOH溶液反应产生气体b L,合并两次收集的气体共有11.2 L(标准状况),问此试样中铝、硅的物质的量分别是多少?
参考答案:Al:0.2mol;Si:0.2mol
本题解析:设每份试样中铝、硅的物质的量分别是x和y,则
2Al+6H+=2Al3++3H2↑
2?3×22.4
x? 33.6x
2Al+2OH-+2H2O=2AlO2-+3H2↑
2? 3×22.4
x? 33.6x
Si+2OH-+H2O=SiO32-+2H2↑
1? 2×22.4
y? 44.8y
因此33.6x+33.6x+44.8y=11.2
另外27x+28y=5.5
解得x=y=0.1mol
所以此试样中铝、硅的物质的量均是0.1mol×2=0.2mol
本题难度:一般