1、填空题 (8分)气体X对氢气的相对密度为22。X可由下列步骤合成(cat表示催化剂):

试根据题意回答下列问题:
(1)X的化学式为 ;X与CO2互为等电子体,所以可推测其分子结构呈 (型)。
(2)液态时的A能与金属钠反应生成F,熔融态的F能与X反应,其中生成一种固体G。G在受撞击时,生成两种单质,其中一种单质能与Li在常温下反应。试写出F+X→G的化学反应方程式 。
(3)D在较稀浓度(2mol/L)时能与Mg反应生成X。试写出化学反应方程式 ?。
(4)实验室制备少量的X,可将B通入K2SO3溶液中制得。请写出该反应的化学方程式 。
参考答案:

本题解析:略
本题难度:一般
2、选择题 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是
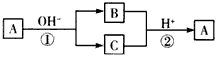
[? ]
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
参考答案:D
本题解析:
本题难度:一般
3、填空题 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
请回答下列问题:
(1)J的化学式为______,I的结构式(或电子式)为______.
(2)反应⑤的化学方程式是:______.
(3)上述转化中,属于氧化还原反应的是(填编号)______.反应④的现象______
(4)在450℃、催化剂存在下,4?mol?F和2?mol?O2反应放热353.9?kJ,此时,F的转化率为90%,则该反应的热化学方程式为:
______.
参考答案:X是黄绿色气体判断为Cl2,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13说明I相对分子质量为26,分子中各原子处于同一直线上.证明是乙炔气体,D、E分子都是10电子微粒,判断E为H2O,Y为CaC2,H为Ca(OH)2;D气体是由H(Ca(OH)2)和G加热反应生成,判断D为NH3,G为NH4Cl,A是由四种短周期元素组成的正盐,D、F都是无色有刺激性气味的气体,F和Cl2,H2O反应,F和NH3,H2O反应,说明F是酸性气体,又是还原性气体,判断F为SO2,A为(NH4)2SO3,B为强碱,C为亚硫酸盐,J为盐酸或硫酸;
(1)依据上述推断,J为H2SO4或HCl,I的结构式为:H-C≡C-H;故答案为:H2SO4或HCl
(2)反应⑤是氯化铵和氢氧化钙加热制备氨气的 反应,反应的化学方程式是:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;
(3)上述反应中①②⑤⑥是复分解反应,③是二氧化硫被氯气氧化的氧化还原反应,④是氨气被氯气氧化的反应属于氧化还原反应;属于氧化还原反应的是:③④;反应④的反应为:氯气和氨气反应生成氮气和氯化铵固体,现象为:产生大量白烟;故答案为:③④;产生大量白烟;
(4)在450℃、催化剂存在下,4 mol F(SO2)和2 mol O2反应放热353.9 kJ,此时,F的转化率为90%,换算为2mol二氧化硫完全反应时放热多少,结合热化学方程式的书写原则写出,4molSO2,转化了4mol×90%=3.6mol,放热353.9 kJ,2molSO2全部反应放热为196.6KJ,则该反应的热化学方程式为:2SO2(g)+O2(g)催化剂.△2SO3(g)△H=-196.6?kJ?mol-1 ;
故答案为:2SO2(g)+O2(g)催化剂.△2SO3(g)△H=-196.6 kJ?mol-1
本题解析:
本题难度:简单
4、简答题 如图所示,已知:
①甲、乙、丙均为前三周期元素的气体单质,丁为固体单质.
②在一定条件下甲与丙、甲与丁都按微粒个数比l:3组成X和Y,在产物中元素甲呈负价.
③在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价.
请填空:
(1)甲是______,乙是______.
(2)写出X、Y的电子式______、______.
(3)乙与丁反应生成W的化学方程式是______.
(4)甲与丙反应生成X的化学方程式是______.
(5)实验室制取X的化学方程式是______.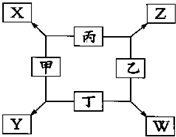
参考答案:甲、乙、丙均为前三周期元素的气体单质为H2、O2、N2、Cl2,丁为固体单质.在一定条件下甲与丙、甲与丁都按微粒个数比l:3组成X和Y,在产物中元素甲呈负价,丙和丁显正价,说明甲是非金属元素形成的单质N2,丙为H2,X为NH3,Y为Mg3N2;在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,在产物中元素乙呈负价,说明乙是非金属元素.所以乙为O2,分别生成Z为H2O,W为MgO,
(1)甲是氮气,乙是氧气,故答案为:N2; O2;
(2)X为NH3,电子式为:

,Y为Mg3N2,电子式为:
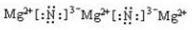
,
故答案为:

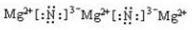
(3)乙与丁反应生成W的化学方程式是镁和氧气的反应,反应化学方程式为:O2+2Mg?点燃?.? 2MgO;
故答案为:O2+2Mg?点燃?.? 2MgO;
(4)甲与丙反应生成X的反应是氨气和氢气合成氨的反应,反应的化学方程式是:N2+3H2?高温高压?.催化剂 2NH3 ,
故答案为:N2+3H2?高温高压?.催化剂 2NH3
(5)实验室制取NH3化学方程式是:2NH4Cl+Ca(OH)2?加热?.? 2NH3↑+CaCl2+2H2O? 故答案为:2NH4Cl+Ca(OH)2?加热?.? 2NH3↑+CaCl2+2H2O.
本题解析:
本题难度:一般
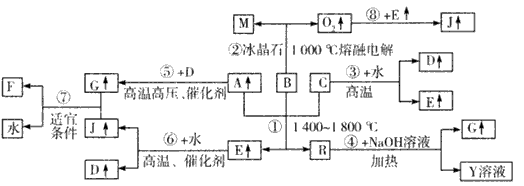
5、推断题 下图涉及多种无机化工反应,所涉及物质都是由短周期元素组成的,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化肥,A、C、D、M均为常见元素的单质,“↑”表 示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2:1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出,洗净后加热分解可以得到B。
请回答下列问题:
(1)写出B的化学式:____ ,F的化学式:____ 。
(2)反应①的化学方程式为___。
(3)反应④的离子方程式为____ 。
(4)上述反应中属于非氧化还原反应的___(填写相应反应的序号)。
(5)Y溶液呈___性(填“酸”、“碱”或“中”),用离子方程式解释:____。
参考答案:(1) Al2O3?; CO( NH2)2
(2)N2 +Al2O3 +3C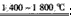 3CO +2AlN
3CO +2AlN
(3)AlN+OH- +H2O=AlO2-+NH3↑
(4)④⑦
(5)碱; AlO2-+2H2O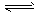 Al(OH) 3 +OH -
Al(OH) 3 +OH -
本题解析:
本题难度:一般