1、选择题 下列叙述正确的是( )
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
参考答案:A.同主族金属元素从上到下,单质的熔沸点逐渐降低,而非金属元素从上到下,单质的熔沸点逐渐升高,故A错误;
B.同一周期元素从左到右原子半径逐渐减小,金属性逐渐减弱,则半径越小越难以失去电子,故B错误;
C.同主族元素从上到下元素的相对原子质量逐渐增大,但O和F的氢化物存在氢键,在同主族中沸点是最高的,故C错误;
D.稀有气体元素的单质从上到下分子间作用力增强,沸点逐渐升高,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 原子序数从3-10的元素,随着核电荷数的递增而逐渐增大的是
A.电子层数
B.电子数
C.原子半径
D.化合价
参考答案:B
本题解析:3-10号元素是同一周期元素,电子层数相同,电子数依次递增,原子半径依次减小.化合价没有明显规律,最高正价递增.
本题难度:一般
3、推断题 已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 _________,Z是_____________ 。
(2)写出③中反应的化学方程式:____________________ 。
(3)写出④中反应的化学方程式:_____________________。
参考答案:(1)Cl(或氯); K(或钾)
(2)Cl2+2KOH==KCl+KClO+H2O
(3)2KClO3 2KCl+3O2↑
2KCl+3O2↑
本题解析:
本题难度:一般
4、选择题 下列叙述中正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.同主族元素的原子,其半径越大,越容易得到电子
C.氧族元素的非金属性比同周期卤素的非金属性弱
D.所有主族元素形成单原子离子时的化合价都和它的族序数相等
参考答案:A、同周期元素原子半径从左到右逐渐减小,所以同周期元素中,ⅦA族元素的原子半径最小,故A错误;
B、同主族元素从上到下原子半径逐渐增大,非金属性逐渐减弱,得电子能力逐渐减弱,故B错误;
C、同周期元素从左到右非金属性逐渐减弱,所以氧族元素的非金属性比同周期卤素的非金属性弱,故C正确;
D、阴离子的化合价的绝对值与最高正价之和等于8,而最高正价等于族序数,所以主族元素形成单原子离子时的化合价不一定与它的族序数相等,如氯离子为-1价,其族序数为7,故D错误;
故选C.
本题解析:
本题难度:简单
5、填空题 19世纪中叶,门捷列夫总结出了如下表所示的元素化学性质的变化规律。请回答
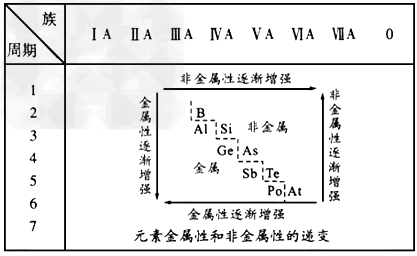
(1)门捷列夫的突出贡献是_______。 ?
A.提出了原子学说?B.提出分子学说 ?C.发现元素周期律?D.发现能量守恒定律
(2)该表变化表明_______。 ?
A.物质的性质总是在不断变化的 ?
B.元素周期表中最右上角的氦元素是非金属性最强的元素 ?
C.第IA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强 ?
D.物质发生量变到一定程度必然引起质变 ?
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到_______。 ?
A.耐高温材料?B.新型农药材料 ?C.半导体材料?D.新型催化剂材料 ?
(4)据报道,美国科学家制得一种新原子283116X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是_______。 ?
A.这种原子的中子数为167 ?B.它位予元素周期表中第六周期 ?
C.这种元素一定是金属元素 ?D.这种元素的原子易与氢化合
参考答案:(1)C?
(2)D?
(3)C?
(4)AC
本题解析:
本题难度:一般