1、选择题 北京2008年奥运会金牌“金镶玉”环形玉壁由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用二氧化硅和金属氧化物的形式可表示为( ? )
A.CaO?MgO?SiO2?H2O
B.2CaO?5MgO?8SiO2?H2O
C.2CaO?MgO?SiO2?2H2O
D.5CaO?2MgO?8SiO2?H2O
参考答案:B
本题解析:
本题难度:简单
2、选择题 工业上冶炼金属铝,经常采用的方法是
A.电解法
B.热分解法
C.热还原法
D.热氧化法
参考答案:A
本题解析:铝是活泼的金属,冶炼的方法是电解熔融的氧化铝,答案选A。
点评:该题是常识性知识的考查,难度不大。该题的关键是明确金属冶炼的原理和方法,即金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。
本题难度:简单
3、选择题 当向下列各组溶液中分别通入CO2后,可能产生白色沉淀的是( )
①澄清石灰水②CaCl2溶液③Ca(HCO3)2溶液④CaCl2和氨水的混合溶液.
A.①④
B.②③
C.①③
D.①②
参考答案:A
本题解析:
本题难度:简单
4、填空题 (14分)草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是?。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。

①则A-B发生反应的化学方程式为:?。
②精确研究表明,B?-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式:??、
?;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为:?。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极?、负极?。
参考答案:(每空2分共14分)
(1)抑制Fe2+水解
(2)①FeC2O4·2H2O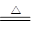 FeC2O4+2H2O
FeC2O4+2H2O
②FeC2O4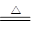 FeCO3+CO↑? FeCO3=FeO+CO2↑
FeCO3+CO↑? FeCO3=FeO+CO2↑
(3)Li2CO3+FeC2O4+SiO2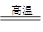 Li2FeSiO4+2CO2+2H2O
Li2FeSiO4+2CO2+2H2O
②LiFeSiO4+Li++e—==Li2FeSiO4 ?Li—e—=Li+
本题解析:(1)由于Fe2+易水解生成浑浊,故需要加入相应的酸抑制其水解
(2)在氩气环境中,二价铁不会被氧化;
①结晶水非常加热易失去,再结合图示数据可知AB段确为失去结晶水的过程:FeC2O4·2H2O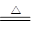 FeC2O4+2H2O
FeC2O4+2H2O
②结合FeC2O4所含有元素及加热所生成的气体只能为CO或CO2,由二者的分子量的大小可知,第一步分解过程中生成的为CO,而第二点分解得到的气体为CO2;
C点所得物质的分子量为:180×40%=72,恰好为FeO的式量;同时由于第二步有CO2的生成,可知第一步分解所得固体物质含碳及氧元素,则可判定为FeCO3
故两步反应分别为:FeC2O4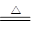 FeCO3+CO↑? FeCO3=FeO+CO2↑
FeCO3+CO↑? FeCO3=FeO+CO2↑
(3)①由元素的守恒、结合反应物及产物的组成、反应条件可综合判定,合成硅酸亚铁锂的化学方程式为:Li2CO3+FeC2O4+SiO2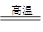 Li2FeSiO4+2CO2+2H2O
Li2FeSiO4+2CO2+2H2O
②由总反应可知,金属锂失电子,化合价生成,做负极:Li—e—=Li+;
由总反应减去负极反应可得正极反应式为:LiFeSiO4+Li++e—==Li2FeSiO4
本题难度:一般
5、选择题 化学与能源开发、环境保护等密切相关。下列说法正确的是
A.开发核能、太阳能、氢能等新能源,使用无磷洗涤剂都可直接降低碳排放
B.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
C.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
D.针对节能减排需要大力建设火电厂
参考答案:C
本题解析:略
本题难度:一般