1、选择题 下列物质中,能使紫色石蕊试液变红的是
A.乙醇
B.苯酚
C.乙醛
D.乙酸
参考答案:D
本题解析:
本题难度:困难
2、填空题 (12分:除注明分数的小题之外,其余为1分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是______________(2分),在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③___________④____________
B请写出通入⑥的化学方程式__________________________________
参考答案:(1)C (1分);(2)1~100 (1分) ;(3)2Fe3++Cu===2Fe2++Cu2+ (1分);
Fe3+、Fe2+、Cu2+;(2分,每少一个扣一分,扣完为止。) 6.0 (1分)
(4)B (1分) (5)A ①Fe ②FeCl2 ③Fe Cu(少一个不得分) ④HCl (各1分)
B 2FeCl2+Cl2=2FeCl3 (1分)
本题解析:(1)因元素的化合价处于中间价态时,既能升高,又能降低,既有氧化性又有还原性,只有C中铁为+2价,符合条件;(2)透明的红褐色液体是胶体,胶体的粒子直径1nm<d<100nm;(3)Fe3+能与铜反应得到Fe2+和Cu2+,离子方程式为: 2Fe3++Cu===2Fe2++Cu2+;由于滴入KSCN溶液呈红色,证明溶液中Fe3+有剩余,溶液中含有的金属阳离子是:Fe3+、Fe2+、Cu2+;43.05g沉淀是AgCl,其物质的量为0.3mol,溶液中c(Cl-)=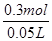 =6.0mol/L;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;C、要证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有Fe2+;C错误;故选B;(5)A、制取的是FeCl3溶液,金属①是Fe;滤液②是FeCl2氯化亚铁溶液;加入的铁过量,滤渣③是Fe和Cu;制取FeCl3,溶解滤渣中的铁,应加入④是盐酸; B、⑥是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。
=6.0mol/L;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;C、要证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有Fe2+;C错误;故选B;(5)A、制取的是FeCl3溶液,金属①是Fe;滤液②是FeCl2氯化亚铁溶液;加入的铁过量,滤渣③是Fe和Cu;制取FeCl3,溶解滤渣中的铁,应加入④是盐酸; B、⑥是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。
考点:考查铁及铁的化合物的性质、胶体的性质。
本题难度:一般
3、选择题 下列不能用带玻璃塞的试剂瓶保存的溶液是
A.硫酸钠溶液
B.烧碱溶液
C.硝酸溶液
D.浓硫酸
参考答案:B
本题解析:分析:玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和强碱反应,能和氢氟酸反应,带玻璃塞的试剂瓶不能存放呈强碱性的物质.
解答:A.硫酸钠溶液,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,故A错误;
B.氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,故B正确;
C.硝酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,故C错误;
D.浓硫酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,故D错误.
故选B.
点评:本题考查了化学试剂的存在,难度不大,注意玻璃的成分中含有二氧化硅,二氧化硅能和强碱或氢氟酸反应,所以强碱溶液不能用带玻璃塞的试剂瓶存放,碱式滴定管下端不是玻璃塞是橡胶管.
本题难度:简单
4、选择题 对电解水的叙述正确的是
A.水能转化为化学能
B.电能转化为化学能
C.电能转化为机械能
D.电能转化为热能
参考答案:B
本题解析:由2H2O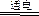 2H2↑+O2↑即知。
2H2↑+O2↑即知。
本题难度:一般
5、选择题 下列反应不属于氧化还原反应的是
A.2H2O2 = 2H2O + O2↑;
B.CuCl2+2NaOH==Cu(OH)2↓+2NaCl
C.2Na+2H2O=2NaOH+H2↑
D.3CO+Fe2O3 ==2Fe+3CO2