1、实验题 实验室配制 500 mL 0.2 mol/L CuSO4溶液,实验操作步骤有:
①用天平称量蓝矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL 容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加少量蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)在天平上称出胆矾的质量为________g。
(2)操作步骤的正确顺序为________(填序号)。
(3)若出现如下情况,所配溶液浓度将有何影响?(填偏高、偏低或无影响)
a.没有进行操作步骤④时,会_______________;
b.定容时俯视刻度线,会__________________。
(4)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应________________。
参考答案:(1)25.0;
(2)①②④③⑤
(3)偏低;偏高
(4)重新配制
本题解析:
本题难度:一般
2、选择题 下列溶液中Cl-的物质的量浓度与l00mL,1mol/L?MgCl2溶液中Cl-的物质的量浓度相同的是( )
A.50mL?2mol/L?CaCl2溶液
B.100mL?2mol/L?NaCl溶液
C.50mL?4mol/L?CaCl2溶液
D.100mL?4mol/L?NaCl溶液
参考答案:100mL?1mol?L-1?MgCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(MgCl2)=2mol/L,
A、50mL0.5mol?L-1CaCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(CaCl2)=1mol/L,故B错误;
B、100mL2mol?L-1NaCl溶液中Cl-的物质的量浓度C(Cl-)=C(NaCl)=2mol/L,故B正确;
C、50mL4mol?L-1CaCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(CaCl2)=8mol/L,故C错误;
D、100mL4mol?L-1NaCl溶液中Cl-的物质的量浓度C(Cl-)=C(NaCl)=4mol/L,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 下列叙述中,正确的是
[? ]
A.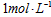 的
的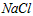 溶液表示:1L溶液中含有
溶液表示:1L溶液中含有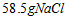
B.用天平称取
C.用 的量筒量取
的量筒量取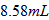 浓盐酸
浓盐酸
D.配制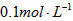 的硫酸溶液时,将量取的浓硫酸放入容量瓶中加入水稀释
的硫酸溶液时,将量取的浓硫酸放入容量瓶中加入水稀释
参考答案:A
本题解析:
本题难度:简单
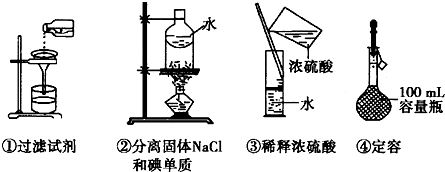
4、选择题 如图所示操作正确的是?
A.只有②
B.②③
C.③④
D.②③④全部错误
参考答案:A
本题解析:分析:①过滤时,要注意一贴二低三靠的原则;
②根据碘易升华而氯化钠加热不挥发;
③根据浓硫酸的稀释方法进行分析判断;
④根据胶头滴管的使用方法.
解答:①过滤液体时,应通过玻璃棒引流,同时漏斗的下端紧靠烧杯内壁,故①错误;
②分离氯化钠和单质碘可用升华的方法,故②正确;
③稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;不能在量筒中稀释,故③错误;
④定容时胶头滴管在滴加液体时不能伸入容量瓶,故④错误;
故选A.
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.
本题难度:一般
5、选择题 相同体积的Na2SO4、MgSO4、Fe2(SO4)3溶液,分别加入足量的BaCl2溶液,产生相同质量的沉淀,则三种溶液的物质的量浓度之比是( )
A.1:1:1
B.1:1:3
C.1:2:3
D.3:3:1
参考答案:加入足量的BaCl2溶液,硫酸根完全沉淀生成BaSO4,生成沉淀BaSO4的质量相同,令BaSO4的d物质的量为1mol,根据硫酸根守恒,则:
n(Na2SO4)=n(BaSO4)=1mol
n(MgSO4)=n(BaSO4)=1mol
n[Fe2(SO4)3]=13n(BaSO4)=13×1mol=13mol,
三种溶液的体积相同,物质的量浓度之比等于物质的量之比,故相同体积的Na2SO4、MgSO4、Fe2(SO4)3溶液的物质的量浓度之比为1mol:1mol:13mol=3:3:1,
故选D.
本题解析:
本题难度:一般