1、选择题 在a LAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为(假设溶液的体积仍为aL)
[? ]
A.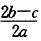
B.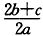
C.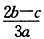
D.
参考答案:C
本题解析:
本题难度:一般
2、选择题 0.5L某浓度的NaCl溶液中含有0.5molNa+,对该溶液的说法不正确的是( )
A.该溶液的物质的量浓度为1mol?L-1
B.该溶液中含有58.5gNaCl
C.配制100mL该溶液需用5.85gNaCl
D.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
参考答案:A、钠离子浓度为1mol/L,氯化钠的物质的量浓度=钠离子物质的量浓度=1mol/L,故A正确;
B、氯化钠的物质的量=钠离子物质的量=0.5mol,质量为0.5mol×58.5g/mol=29.25g,故B错误;
C、氯化钠的物质的量浓度为1mol/L,配制100mL该溶液需用5.85gNaCl质量为0.1L×1mol/L×58.5g/mol=5.85g,故C正确;
D、溶液中钠离子浓度为1mol/L,100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1L×1mol/L=0.1mol,故D正确.
故选B.
本题解析:
本题难度:一般
3、选择题 某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低.该学生得出了以下原因,其中是使溶液浓度偏低的原因的是( )
A.容量瓶刚用氢氧化钠溶液润洗过
B.在转移溶液时不小心洒落瓶外
C.在烧杯中溶解了氢氧化钠后,趁热将溶液到入容量瓶,并迅速配成了溶液
D.定容时,俯视刻度线
参考答案:B
本题解析:
本题难度:简单
4、简答题 标准状况下,有氧气和氯气组成的混合气体共500mL,通入氢气,使其恰好完全燃烧,用水吸收,得250mL盐酸溶液,从中取出20mL,用0.08mol/LNaOH25mL恰好中和.试计算:
(1)盐酸溶液的物质的量浓度是______.
(2)与混合气体反应的氢气体积是______mL(标准状况).
参考答案:(1)发生反应:HCl+NaOH=NaCl+H2O,HCl与NaOH按物质的量1:1反应,令盐酸溶液的物质的量浓度为cmol/L,
则25mL×c=25mL×0.08mol?L-1,解得c=0.08mol?L-1,故答案为:0.08mol?L-1 ;
(2)250mL溶液中n(HCl)=0.08mol?L-1×0.25L=0.02mol,
根据H原子守恒可知n(Cl2)=12×0.02mol=0.01mol,则V(Cl2)=0.01mol×22.4L/mol=0.224L,氧气的体积为500mL-224mL=276mL,
H2+Cl2=2HCl
224mL 224mL
2H2+O2=2H2O
552mL 276mL
故通入氢气体积为224mL+552mL=776mL,
故答案为:776.
本题解析:
本题难度:一般
5、填空题 有一质量为mg,相对分子质量为M的某种强碱M(OH)2,在一定温度下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为______,溶质的质量分数为______,此温度下该碱的溶解度为______.
参考答案:M(OH)2的摩尔质量为Mg/mol,mg该强碱的物质的量为mMmol,含有氢氧根离子的物质的量为2×mMmol,溶液中氢氧根离子的物质的量浓度为:2mMmolV×10-3L=2000mMVmol/L;
配制的溶液的质量为:ρg/cm3×VmL=ρVg,溶质的质量分数为:mρV×100%=100mρV%,
此温度下该碱的溶解度S=m溶质m溶剂×100g=mρV-m×100g=100mρV-mg,
故答案为:2000mMVmol/L;100mρV%;100mρV-mg.
本题解析:
本题难度:一般