|
|
|
高考化学试题《物质组成与性质实验方案的设计》考点强化练习(2020年押题版)(十)
2025-06-26 02:47:07
【 大 中 小】
|
1、实验题 为了验证“铁丝可以在纯净的氧气中燃烧”及“燃烧产物有中Fe2+、Fe3+的存在”。同学们将一根火柴棒塞入一段螺旋状普通细铁丝末端固定;用镊子将铁丝夹住,然后将火柴在酒精灯上点燃,将铁丝由集气瓶口向下慢慢深入,观察现象:
(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因?(填序号):
A.氧气不纯(或没收集满)
B.火柴太长消耗了氧气
C.铁丝表面有氧化物(或铁锈)
D.没有预热末端铁丝,温度没有达到铁丝的着火点
| (2)乙同学做了一些准备工作,当铁丝在纯净氧气中燃烧时,火星四射,并有黑色固体生成。现有实验用品:细纯铁铁丝、细含碳铁丝、镁条、细铜丝、集气瓶装的几瓶纯氧、火柴、酒精灯、镊子、砂纸等。请回答:
①你对“没有火焰”的现象,能提出的问题是:?;验证方法是:?。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
?。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是:?。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:

试回答下列问题:
①试剂1是?,试剂2是?。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)?
?。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗??。若你认为不合理,请提出你的猜想?,并设计一个简单的实验加以验证(若你认为合理,该空不要作答)?。
参考答案:(1)ABCD(填对2个给1分,全对2分)。(2)①是否所有金属在纯氧中燃烧都没有火焰(1分);取镁条或细铜丝(1分)用同样方法点燃伸入装纯氧的集气瓶,观察是否有火焰(1分)。②若为铁丝中含碳引起的(1分),应取细纯铁铁丝、细含碳铁丝分别在纯氧中点燃观察(1分);若所有金属丝在纯氧中燃烧都会火星四射(1分),则应同时取上述几种金属丝用砂子将表面打磨后分别在纯氧中燃烧观察现象(1分)。③(1分)燃烧时炭粒生成的气体CO2在熔融液态铁中形成气泡而炸裂。(3)①稀盐酸或硫酸(1分);KSCN溶液(1分);②2Fe2++C12=2Fe3++2C1-、Fe3++SCN-=[Fe(SCN)]2+;(2分);③不合理(1分);猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化(2分);设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)(1分)。
本题解析:(1)可首先从燃烧的条件探索,氧气的量不足或温度未达到着火点,其次从铁丝的本身考虑,结合金属镁铝的表面的氧化物薄膜的缘故。故ABCD都有可能。(2)没有火焰是否所有金属在纯氧中燃烧都没有火焰,可取活泼性相近的镁条或常见的细铜丝用同样方法点燃伸入装纯氧的集气瓶,观察是否有火焰来验证。“火星四射”同于爆炸,可能是铁丝中含碳燃烧产生的CO2所致,故应取细纯铁铁丝和细含碳铁丝分别在纯氧中点燃观察分析。(3)所加的试剂1应能溶解铁的氧化物且不能将其中的物质氧化,则只能取稀盐酸或稀硫酸,而不能用氧化性的酸。加入试剂2后溶液变为血红色,则由于其中含有Fe3+,故应加入的含有SCN-的溶液,如KSCN溶液。滴加氯水溶液颜色加深,是由于发生了反应:2Fe2++C12=2Fe3++2C1-、Fe3++SCN-=[Fe(SCN)]2+,[Fe(SCN)]2+浓度增大。猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化;设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色或在褪色后溶液加入加入KSCN溶液,变红色。
本题难度:一般
2、实验题 请设计CO2在高温下与木炭反应生成CO的实验。
(1)在图2中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B,C……;其他可选用的仪器(数量不限)简易表示如图1;


(2)根据方框中的装置图,填写该表

(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是_____________________________________。
(4)验证CO的方法是_________________________________。
参考答案:(1)
(2)
(3)可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封的作用,防止反应剧烈时气体经漏斗冲出
(4)点燃气体,火焰呈监色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
本题解析:
本题难度:一般
3、实验题 某化学兴趣小组利用如图所示装置(部分夹持仪器已省略) 进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题。
|
|
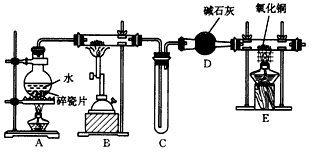
(1)E中的现象是__________________。
(2)A、B两个装置中应先点燃____处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_________。
参考答案:(1)黑色固体变为红色,硬质玻璃管右端管壁有液滴生成
(2)A;收集H2,并检验其纯度
本题解析:
本题难度:一般
4、选择题 工业上用洗净的废铜片作原料制备硝酸铜,为了节约原料和防止污染环境,宜采用的方法是( )
A.Cu+HNO3(浓)
B.Cu+HNO3(稀)
C.Cu+O2再加HNO3
D.Cu+H2SO4(浓)再加Ba(NO3)2
参考答案:A.浓硝酸与铜反应,制备1molCu(NO3)2,需要4molHNO3,中放出2molNO2气体NO2;
B.稀硝酸与铜反应生,制备1molCu(NO3)2,需要83molHNO3,放出 23molNO气体;
C.铜与氧气反应生成CuO,制备1molCu(NO3)2,需要2molHNO3,且没有生成污染性气体;
D.铜与浓硫酸反应生成污染性气体二氧化硫.
由上述分析可知,C选项中方案,消耗原料少,且基本无污染.
故选:C.
本题解析:
本题难度:简单
5、实验题 新装修的居室内,甲醛浓度往往很大.严重污染空气.居住者接触时间较长易得白血病。1×10—5mol·L—1的紫色KMnO4溶液遇甲醛气体即褪色。用下面的微型化学实验可测定室内空气甲醛含量:
(1) 试设计实验,在中学实验室里配制100mL l.00×10-4mol·L-1KMnO4溶液;
(2) 用2.5mL注射器准确量取2mL l.00×10—4mol·L—1KMnO4溶液,注入六孔穴板1*孔内,加入3滴6 mol·L—1H2SO4溶液,盖好塞子;按图连接好装置。将此装置置于待测地点,缓慢抽气,每次抽气50mL,直到溶液红色褪去,记录抽气次数。已知有关反应为:5HCHO+4KMnO4+6H2SO4 5CO2+11H2O+2K2SO4+4MnSO4
5CO2+11H2O+2K2SO4+4MnSO4
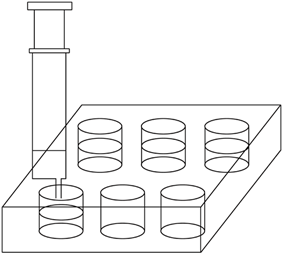
(3) 设抽气次数为n,试计算甲醛在空气中的含量(mg/m3)。
(4) 若室内空气中甲醛气体最高允许浓度为20mg·m-3试分析讨论室内空气符合标准时n的取值范围。
(5) 为保证实验结果精确性,实验过程中应注意什么?
参考答案:(1)准确称取1.9gKMnO4用少量水溶解,转移入1000mL容量瓶中,定容。再准确取此溶液1mL于100mL容量瓶中定容,得到1.00×10-4mol·L-1KMnO4溶液。(3) 150/n(mg/m3) (4) n≥8符合标准(5)抽气时应慢慢地抽拉活塞,否则反应不完全,测定结果偏低。KMnO4应随配随用。
本题解析::涉及微型实验的考核值得关注,本题属于定量实验的考查,着重考查学生处理实验数据的能力和实事求是的科学态度。如浓度的配制,若缺乏处理数据的能力,就会导致用天平去称量质量很小的高锰酸钾,这在中学实验中是达不到的。(1) 准确称取1.9gKMnO4用少量水溶解,转移入1000mL容量瓶中,定容。再准确取此溶液1mL于100mL容量瓶中定容,得到1.00×10-4mol·L-1KMnO4溶液。 (3) 150/n(mg/m3) (4) n≥8符合标准(5)抽气时应慢慢地抽拉活塞,否则反应不完全,测定结果偏低。KMnO4应随配随用(想一想,如何从题意中得出这个区分度较大的答案的)。
本题难度:一般
