1、选择题 等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是(?)
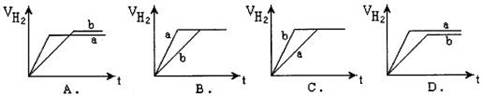
参考答案:A
本题解析:向a中加入少量的CuSO4溶液,部分锌和硫酸铜反应,生成的氢气减少,生成的铜覆盖在锌的表面,构成原电池,加快反应速率,故选A。
本题难度:一般
2、选择题 对于反应N2+O2 2NO,在密闭容器中进行,下列哪些条件能加快该反应的速率(?)
2NO,在密闭容器中进行,下列哪些条件能加快该反应的速率(?)
A.缩小体积使压强增大
B.体积不变充入N2使压强增大
C.体积不变充入He气使压强增大
D.压强不变充入N2使体积增大
参考答案:AB
本题解析:压强对速率的影响,本质上是浓度的影响。
A.缩小反应体系的体积,总压增大,各物质的浓度均增大,故反应速率加快。
B.体积不变,充入N2,反应物浓度增大,反应速率加快。
C.体积不变,充入He,总压虽增大,但体系中各物质浓度均没有改变,故反应速率不变。
D.压强不变充入N2,导致体积增大,各物质的浓度除N2不变外,其余均减小,故反应速率减慢。
本题难度:一般
3、填空题 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
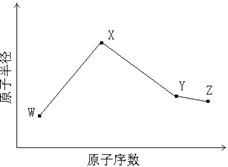
(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 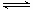 2A(g) △H =-92.4 kJ?mol
2A(g) △H =-92.4 kJ?mol
参考答案:
本题解析:
本题难度:困难
4、填空题 在密闭容器中发生下列反应:I2(g)+H2(g)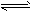 2HI(g)(正反应吸热) 起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
2HI(g)(正反应吸热) 起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。

参考答案:(1)增大
(2)增大
(3)增大
(4)减小
(5)不变
本题解析:
本题难度:一般
5、选择题 对于如下反应,其反应过程的能量变化示意图如图:

编号
| 反应
| 平衡常数
| 反应热
|
反应①
| A(g)=B(g)+C(g)
| K1
| △H1
|
反应②
| B(g)+C(g)=D(g)
| K2
| △H2
|
反应③
| A(g)= D(g)
| K3
| △H3
|
下列说法正确的是
A.K3 =K1 + K2 B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变
参考答案:B
本题解析:由反应可知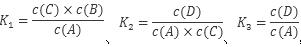 、,故K3 =K1 × K2,故A项错误;由盖斯定律可知△H3=△H1 +△H2,故B项正确;催化剂只能降低反应活化能,是活化分子百分率增多,反应速率加快,但不会影响反应热,故C项错误;化学平衡常数只与温度有关,增大压强反应温度不变,故各反应的平衡常数不变,故D项错误;本题选B。
、,故K3 =K1 × K2,故A项错误;由盖斯定律可知△H3=△H1 +△H2,故B项正确;催化剂只能降低反应活化能,是活化分子百分率增多,反应速率加快,但不会影响反应热,故C项错误;化学平衡常数只与温度有关,增大压强反应温度不变,故各反应的平衡常数不变,故D项错误;本题选B。
考点:化学平衡及能量变化。
本题难度:困难