1、填空题 火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被氧化的元素是?,氧化剂是??和 ??
参考答案:(3分) 碳;? KNO3和硫;?各1分
本题解析:关键方程式可知,硝酸钾中氮元素的化合价从+5价降低到+4价,得到1个电子。碳元素的化合价从0价升高到+4价,失去4个电子;S元素的化合价从0价降低到-2价,得到2个电子,所以被氧化的元素是碳,氧化剂是硝酸钾和S。
点评:该题是基础性试题的考查,试题侧重考查学生的基础知识,难度不大。该题的关键是准确标出有关元素的化合价,然后依据题意灵活运用即可。
本题难度:一般
2、填空题 (1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V? b.V2+? c.VO2+? d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
参考答案:(1)V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O
(2)ClO3-+6V6e-O2++3H2O=Cl-+6VO2++6H+
(3)b
(4)Cl2+SO32-+H2O=2Cl-+2H++SO42-
本题解析:(1)K2SO3为还原剂,氧化产物为K2SO4,V2O5为氧化剂,还原产物为VO2+。
(2)KClO3把VO2+氧化成VO2+,本身还原成Cl-,离子方程式为ClO3-+6VO2++3H2O=
Cl-+6VO2++6H+,转移6 mol e-。
(3)根据电子得失守恒得:
 ×2=0.02 mol×0.1 mol·L-1×(5-x)
×2=0.02 mol×0.1 mol·L-1×(5-x)
x=2,b正确。
(4)由已知得:Cl->VO2+,根据Cl2+SO32-+H2O=2Cl-+2H++SO42-
可推出还原性SO32->Cl-。
本题难度:一般
3、填空题 已知复印机工作时易产生臭氧,臭氧浓度过高时对人体有害.臭氧具有强氧化性,可以使湿润的碘化钾淀粉试纸变蓝,其中臭氧部分转化为氧气.
(1)写出并配平发生反应的离子方程式________.?
(2)该反应的氧化剂是________,还原产物是________________.
(3)该反应包含两种反应:①氧化反应为________转化为________,②还原反应过程的反应式为________.
(4)反应中1?mol臭氧________(填“得到”或“失去”)________mol电子.
参考答案:(1)O3+2I-+H2O===2OH-+I2+O2
(2)O3 ;OH-(或KOH)
(3)①I- ;I2
②O3+H2O+2e-===2OH-+O2
(4)得到 ;2
本题解析:
本题难度:一般
4、填空题 根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O?回答下列问题:
(1)氧化剂是?,氧化产物是?。
(2)氧化剂与氧化产物的物质的量比是?。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为?,反应中转移的电子数为?;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
参考答案:(1)HNO3?Cu(NO3)3?(2)2:3?(3)192g? 6NA或3.612×1024
(4)K2SO3 + KIO3 + H2SO4 →I2 + K2SO4 + H2O
本题解析:在反应中铜的化合价由0→+2价,被氧化,作还原剂生成氧化产物Cu(NO3)3。HNO3中氮的化合价由+5→+2价,被还原,作氧化剂,生成还原产物N0。在反应中8?mol HNO3反应,只有2mol HNO3作氧化剂,其质量为3mol×64g∕mol=192g.氧化剂与氧化产物的物质的量比,2:3.转移转移的电子数为:3×2NA=6NA=3.612×1024。在反应中K2SO3失去电子,说明它是还原剂,被氧化成K2SO4,给定的物质有强氧化性可以作氧化剂的的是KIO3,KIO3在酸性条件下表现氧化性生成的还原产物I2,根据化学反应的过程就是原子重新组合的过程可知:这几种物质组合的反应为K2SO3 + KIO3 + H2SO4 →I2 + K2SO4 + H2O。
本题难度:一般
5、计算题 (8分)根据Cu+2H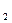 SO
SO (浓)
(浓) CuSO
CuSO +SO
+SO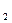 ↑+2H
↑+2H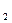 O完成以下问题(已知Cu的相对原子质量为64):
O完成以下问题(已知Cu的相对原子质量为64):
(1)该反应中氧化剂是____________,被氧化的元素是______________。
(2)当有32 g Cu 溶解时,被还原的H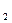 SO
SO 的质量为___________g。
的质量为___________g。
参考答案:(1)H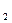 SO
SO Cu
Cu
(2)49
本题解析:Cu元素化合价升高,H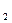 SO
SO 中S元素化合价降低,因此可回答(1)。此反应中,每2个H
中S元素化合价降低,因此可回答(1)。此反应中,每2个H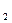 SO
SO 分子参与反应,只有1个H
分子参与反应,只有1个H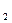 SO
SO 分子被还原,即64 g Cu 溶解时,只有98 g H
分子被还原,即64 g Cu 溶解时,只有98 g H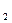 SO
SO ?被还原。
?被还原。
本题难度:一般