|
高中化学必备知识点《影响盐类水解的因素》高频试题特训(2020年最新版)(四)
2025-06-26 04:07:22
【 大 中 小】
|
1、选择题 KOH溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A.c(K+)>c(OH-)>c(A-)>c(H+)
B.c(K+)>c(A-)>c(OH-)>c(H+)
C.c(K+)>c(A-)>c(H+)>c(OH-)
D.c(K+)>c(H+)>c(A-)>c(OH-)
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列叙述正确的是
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.常温下,在1L lmol·L-1的氨水 与2L 0.5 mol·L-1的氨水中,n(NH4+)前者多 与2L 0.5 mol·L-1的氨水中,n(NH4+)前者多
C.中和相同体积、相同pH的盐酸和醋酸,消耗NaOH的物质的量盐酸比醋酸大
D.0.2 mol·L-1的酸HX与0.1 mol·L-1的KOH溶液等体积混合溶液中,一定有:
| c(X-) > c(K+)>c(H+)> c(OH-)
参考答案:A
本题解析:略
本题难度:一般
3、实验题 向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中的碳酸氢根离子浓度变化趋势可能是:
A.逐渐减小;
B.逐渐增大;
C.先逐渐增大,而后减小;
D.先逐渐减小,而后增大。你的选择是____(填正确选项的标号)。试用化学方程式和简要文字表达其理由。____________________
参考答案:C?
Na2CO3==2Na++CO32-
CO32-+H+==HCO3-
所以溶液中HCO3-浓度逐渐增大。而后:
HCO3-+H+==H2CO3
H2CO3==H2O+CO2↑
所以溶液中HCO3-浓度逐渐减小。
本题解析:本题考查离子反应的知识,同时考查文字表达能力。
Na2CO3的浓溶液中CO32-的浓度很大,滴入盐酸后,H+与CO32-结合生成HCO3-,生成的HCO3-越来越多;当CO32-都转变为HCO3-之后,继续滴加盐酸,则H+与HCO3-又结合生成H2CO3,H2CO3则分解为CO2和H2O,使溶液中的HCO3-逐渐减小。
正确选项为(C),其理由表述如下:
首先:Na2CO3==2Na++CO32-
CO32-+H+==HCO3-
所以溶液中HCO3-浓度逐渐增大。而后:
HCO3-+H+==H2CO3
H2CO3==H2O+CO2↑
所以溶液中HCO3-浓度逐渐减小。
本题难度:一般
4、填空题 (10分)常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3·H2O,回答相关问题:
(1)上述溶液中,可发生水解的是?(填序号)
(2)上述溶液中,既能与NaOH溶液反应,又能与H2SO4溶液反应的溶
液中,离子浓度大小的关系?
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值?(“增大”、“减小”或“不变” )
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积?④的体积(“大于”、“小于”或“等于” )
(5)取10mL的③溶液,加水稀释到500mL,则此溶液中由水电离出的c(H+) =?mol/L
参考答案:(10分)
(1)?①②?
(2)? c(Na+)> c(HCO3—) > c(OH—) > c(H+)> c(CO32—)?
(3)?增大??(4)?小于?
(5)? 10-11?
本题解析:(1)在盐溶液中,只有含有弱离子才能水解,所以,上述溶液中可发生水解的是:Na2CO3、NaHCO3,所以填①②
(2)既能与NaOH溶液反应,又能与H2SO4溶液反应的溶液指的是NaHCO3,NaHCO3溶液显碱性,HCO3-的水解程度大于电离程度。离子浓度的大小关系是:c(Na+)> c(HCO3—) > c(OH—) > c(H+)> c(CO32—)
(3)向④中加入少量NH4Cl固体,④存在一水合氨的电离平衡,氨根离子浓度增大,平衡左移,此时c(NH4+/OH-)的值增大。
(4)若将③和④的溶液混合后,会得到氯化铵,溶液恰好呈中性,氨水应该过量,所以,混合前③的体积小于④的体积
(5)0.05mol/L10mL的HCl溶液,加水稀释到500mL,此时盐酸的浓度为0.001mol/L, c(H+) = 10-3mol/L,那么水电离出的c(H+)=10-11mol/L
本题难度:一般
5、选择题 已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与bmol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c( )+c( )+c(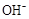 )<c(CH3COOH)+c(H+) )<c(CH3COOH)+c(H+)
参考答案:C D
本题解析:A、正确,CH3COOH>H2CO3>HCN>HCO3—酸性越强对应的盐水解能力越弱,等物质的量浓度的各溶液pH越小;B、正确,CN―离子要水解,现c(Na+)=c(CN-),HCN一定要过量,a一定大于b;C、不正确,质子守恒的式子为:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);D、不正确,
本题难度:一般
|