微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 28(15分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
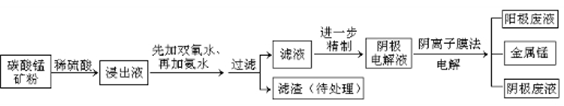
阴离子膜法电解装置如图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
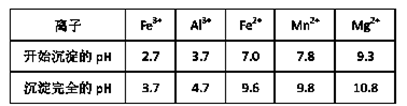
加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,以石墨为电极,阳极区以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 & #160; 。
填空题 28(15分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:

加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,以石墨为电极,阳极区以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
本题答案:(1)MnCO3+2H+=Mn2++CO2↑+H2O
本题解析:
试题分析:将碳酸锰矿粉溶于稀硫酸中,MnCO3、FeCO3、MgO、Al2O3都和稀硫酸反应生成硫酸盐,酸性条件下,MnO2被亚铁离子还原生成Mn2+,SiO2以沉淀析出,然后向浸出液中先加双氧水,再加氯水,并调节溶液的pH到6,根据氢氧化物沉淀需要的pH,当pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用离子交换膜电解。
(1)碳酸锰和稀硫酸反应生成硫酸锰,二氧化碳和水,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O;(2)加入双氧水时将亚铁离子氧化为铁离子,根据氢氧化物沉淀需要的pH知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,滤液中含有的阳离子为H+、Mn2+、Mg2+、NH4+;(3)酸性条件下,MnO2被亚铁离子还原,亚铁离子被氧化生成铁离子,所以在浸出液里锰元素只以锰离子的形式存在,且滤渣中无MnO2;(4)根据阴离子移动方向可知,左边电极是阴极,右边电极是阳极,则连接阴极的电极A是电源的负极,阳极上氢氧根离子放电生成氧气,电极反应为4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+;(5)锰离子不稳定,易被氧化生成二氧化锰,所以阳极的副反应为Mn2++2H2O-2e-=MnO2+4H+。
考点:物质分离和提纯的方法和基本操作综合应用、电解原理
点评:本题主要考查混合物的分离和提纯,侧重考查学生对知识的综合运用能力,涉及内容较多,难度较大。
本题所属考点:【电解池原理】
本题难易程度:【困难】
A birbe will enter without knocking. 贿赂毋须敲门而入。