微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃来源:91考试网 91ExAm.org烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。

①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
填空题 (9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性 燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。

①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
本题答案:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l)
本题解析:
试题分析:(1)1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),则1molN2H4即32g在氧气中完全燃烧生成氮气和H2O,放出19.5kJ×32=624 kJ热量,因此表示N2H4燃烧热的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
(2)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应,因此该原电池中正极反应式为O2+2H2O+4e-=4OH-,负极是肼失去电子,电极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是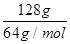 ×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
考点:考查热化学方程式书写以及电化学原理的应用
本题所属考点:【原电池原理】
本题难易程度:【一般】
You cannot make a silk purse out of sow's ear. 用猪耳朵做不成丝钱包。