|
|
|
下列有关说法正确的是( )A.常温下,0.1 mol·【盐类水解的原理】
2016-12-25 16:00:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列有关说法正确的是( )
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,
溶液中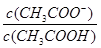 的值增大到原来的10倍 的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中:
| c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
91exam.org
选择题 下列有关说法正确的是( )
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH 从3.0升到4.0时,
溶液中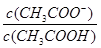 的值增大到原来的10倍 的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中:
|
c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
本题答案:C
本题解析:
试题分析:A、根据质子守恒可得c(OH—)=c(H+) + c(HS—) + 2c(H2S),错误;B、HA的酸性未知,若为强酸,则存在c(Na+)=c(A—)>c(OH—)=c(H+),若为弱酸则有c(Na+)>c(A—)>c(OH—)>c(H+),错误;C、醋酸是弱酸,当溶液的pH从3.0升到4.0时,氢离子变为原来的0.1倍,根据电离平衡常数只随温度而变化的特点,所以K不变时,
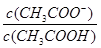
需增大到原来的10倍,才能保持K不变,正确;D、常温下pH=7的溶液为中性,所以c(H+)=c(OH—),根据电荷守恒得c(Na+)=c(CH3COO—),错误,答案选C。
考点:考查溶液中离子浓度的比较,守恒规律的应用,电离平衡常数的应用
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
Life is sweet. 人生是美好的.
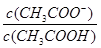 需增大到原来的10倍,才能保持K不变,正确;D、常温下pH=7的溶液为中性,所以c(H+)=c(OH—),根据电荷守恒得c(Na+)=c(CH3COO—),错误,答案选C。
需增大到原来的10倍,才能保持K不变,正确;D、常温下pH=7的溶液为中性,所以c(H+)=c(OH—),根据电荷守恒得c(Na+)=c(CH3COO—),错误,答案选C。