微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
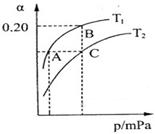
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO
| HSCN
| H2CO3
|
K=3.2×10-8
| K=0.13
| Kl=4.2×10-7
K2=5.6×10-11
|
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 ;
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是 (用A.B.C回答)
填空题 (16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。

回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO
| HSCN
| H2CO3
|
K=3.2×10-8
| K=0.13
| Kl=4.2×10-7
K2=5.6×10-11
|
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是 (用A.B.C回答)
本题答案:(1)难以控制反应只生成CO和水 (2分)
(2)①0
本题解析:
试题分析:A、(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量的原因是甲烷燃烧生成一氧化碳的反应不易控制,无法准确测定;(2)①反应达到平衡状态B时,氮气的转化率为20%,容器的容积10L,
N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始量(mol/L) 1 2.6 0
变化量(mol/L) 1×20%=0.2 0.6 0.4
平衡量(mol/L) 0.8 2 来源:91考试 网; 0.4
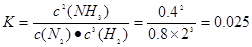 ,故答案为:0.025;
,故答案为:0.025;
②N2(g)+3H2(g) 2NH3(g)△H<0,正反应为放热反应,降低温度,平衡向正反应方向移动,氮气转化率增大,图象分析判断T1<T2,平衡状态由A变到C时,温度升高平衡常数减小,所以平衡常数K(A)>K(C),平衡状态由A变到B时,温度不变平衡常数不变,所以平衡常数K(A)=K(B);(3)①KSCN溶液中SCN-水解显碱性,溶液中离子浓度大小为c(K+)>c(SCN-)>c(OH-)>c(H+);
2NH3(g)△H<0,正反应为放热反应,降低温度,平衡向正反应方向移动,氮气转化率增大,图象分析判断T1<T2,平衡状态由A变到C时,温度升高平衡常数减小,所以平衡常数K(A)>K(C),平衡状态由A变到B时,温度不变平衡常数不变,所以平衡常数K(A)=K(B);(3)①KSCN溶液中SCN-水解显碱性,溶液中离子浓度大小为c(K+)>c(SCN-)>c(OH-)>c(H+);
②分析电离平衡常数可知HSCN>H2CO3>HClO;碳酸钠和次氯酸反应生成碳酸氢钠和次氯酸钠,反应的化学方程式为:Na2CO3+HClO=NaHCO3+NaClO;
③由于酸性HSCN>H2CO3>HClO>HCO3-,故同浓度的NaClO、 Na2CO3、NaSCN 三种溶液的水解程度由大到小为:Na2CO3>NaClO>NaSCN,故PH值由大到小为B>A>C。
考点:考查热化学方程式和盖斯定律的计算应用,化学平衡常数计算和影响因素分析,盐类水解和弱电解质电离程度分析判断。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】
A good name is sooner lost than won. 美名难得而易失.