微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分) (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。
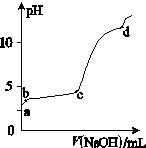
(1)写出a点溶液呈酸性的离子方程式: ;
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式: ,
(4)d点时,V(NaOH)约为
(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
填空题 (11分) (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。

(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式: ,
(4)d点时,V(NaOH)约为
(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
本题答案: (Ⅰ) (1) Al3++3H2O (1)Al2(SO4)3是强酸弱碱盐,在溶液中Al3+会发生水解反应消耗水电离产生的OH-,使溶液中c(H+)>c(OH-),所以最终使溶液显酸性,离子方程式是:Al3+ +3H2O <img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) Al(OH)3+3OH-;(2)若c点时V(NaOH)为90ml,溶液的pH="5," Al2(SO4)3溶液的pH增大一倍,在加入NaOH,溶液 pH会发生大的变化,说明Al2(SO4)3恰好反应完全。根据反应方程式:Al3++3OH- = Al(OH)3↓,n(OH-)=0.09L×1.0mol/L=0.09mol,则n(Al3+)=0.03mol,n(Al2(SO4)3)=0.015mol,则Al2(SO4)3溶液的物质的量浓度约为:0.015mol÷0.03L=0.5 mol/L; (3)在b~c段反应的离子方程式是Al3++3OH- = Al(OH)3↓;(4) 在d点时,产生的Al(OH)3恰好被完全溶解,根据反应方程式Al(OH)3+ OH-= AlO2-+ 2H2O可知:n(Al(OH)3)=n(Al3+)=0.03mol又消耗NaOH的物质的量是0.03mol,其体积是0.03mol÷ 1mol/L=" 0.03L=" 30ml,所以V(NaOH)约为90ml+30ml=120ml;(Ⅱ) (1) 在氨水中存在电离平衡:NH3·H2O
Al(OH)3+3OH-;(2)若c点时V(NaOH)为90ml,溶液的pH="5," Al2(SO4)3溶液的pH增大一倍,在加入NaOH,溶液 pH会发生大的变化,说明Al2(SO4)3恰好反应完全。根据反应方程式:Al3++3OH- = Al(OH)3↓,n(OH-)=0.09L×1.0mol/L=0.09mol,则n(Al3+)=0.03mol,n(Al2(SO4)3)=0.015mol,则Al2(SO4)3溶液的物质的量浓度约为:0.015mol÷0.03L=0.5 mol/L; (3)在b~c段反应的离子方程式是Al3++3OH- = Al(OH)3↓;(4) 在d点时,产生的Al(OH)3恰好被完全溶解,根据反应方程式Al(OH)3+ OH-= AlO2-+ 2H2O可知:n(Al(OH)3)=n(Al3+)=0.03mol又消耗NaOH的物质的量是0.03mol,其体积是0.03mol÷ 1mol/L=" 0.03L=" 30ml,所以V(NaOH)约为90ml+30ml=120ml;(Ⅱ) (1) 在氨水中存在电离平衡:NH3·H2O NH4++OH-,若向其中中加入少量氯化铵固体,由于c(NH4+)增大,平衡逆向移动,c(OH-)减小,但是平衡移动的趋势是微弱的,总的来说,c(NH4+)增大,所以此时c(NH4+)/c(OH-)的值增大;(2)盐酸是强酸,完全电离,一水合氨是弱碱,部分电离,原来二者的浓度相等,所以若将③HCl和④氨水的溶液等体积混合,则二者恰好反应,醋酸的盐是强酸弱碱盐盐,水解使溶液显酸性,而为了使混合后溶液恰好呈中性,则混合前③的体积要略小于④的体积。盐电离产生的两种浓度远大于水的电离产生的离子浓度,所以根据电荷守恒及溶液显中性可知此时溶液中离子浓度由大到小的顺序是c(Cl-)=c(NH
NH4++OH-,若向其中中加入少量氯化铵固体,由于c(NH4+)增大,平衡逆向移动,c(OH-)减小,但是平衡移动的趋势是微弱的,总的来说,c(NH4+)增大,所以此时c(NH4+)/c(OH-)的值增大;(2)盐酸是强酸,完全电离,一水合氨是弱碱,部分电离,原来二者的浓度相等,所以若将③HCl和④氨水的溶液等体积混合,则二者恰好反应,醋酸的盐是强酸弱碱盐盐,水解使溶液显酸性,而为了使混合后溶液恰好呈中性,则混合前③的体积要略小于④的体积。盐电离产生的两种浓度远大于水的电离产生的离子浓度,所以根据电荷守恒及溶液显中性可知此时溶液中离子浓度由大到小的顺序是c(Cl-)=c(NH )>c(OH-)=c(H+)。
)>c(OH-)=c(H+)。
考点:考查盐的水解平衡及影响因素、盐与碱反应时的物质的量的关系、溶液中离子浓度的大小关系的比较的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
Life is short and time is swift. 生命短暂,光阴飞逝.