|
|
|
常温下,下列溶液中的微粒浓度关系正确的是A.氯气通入氢氧?【盐类水解的原理】
2016-12-25 17:05:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
选择题 常温下,下列溶液中的微粒浓度关系正确的是
A.氯气通入氢氧化钠溶液中: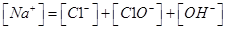
B.pH=8.3的NaHCO3溶液: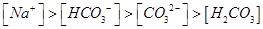
C.pH=11的氨水与pH=3的盐酸等体积混合:
D.某溶液中只存在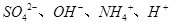 四种离子,则可能存在: 四种离子,则可能存在: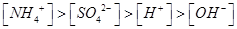
|
本题答案:D
本题解析:
试题分析:A、氯气通入氢氧化钠溶液中,生成氯化钠、次氯酸钠和水,根据电荷守恒,则c(Na+)+ c(H+)= c(OH-)+ c(Cl-)> c(ClO-),错误;B、pH=8.3的NaHCO3溶液为碱性溶液,碳酸氢根离子的水解程度大于其电离程度,则c(Na+)> c(HCO3-)> c(H2CO3)> c(CO32-),错误;C、pH=11的氨水中的氢氧根离子浓度与pH=3的盐酸中氢离子的浓度相等,但氨水是弱碱溶液,则氨水的浓度大于盐酸的浓度,所以等体积混合,氨水过量,溶液呈碱性,不是中性,错误;D、某溶液中只存在
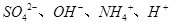
四种离子,则该溶液中的溶质可能是硫酸铵,则溶液呈酸性,c(NH4+)> c(SO42-)> c(H+)>c(OH-),正确,答案选D。
考点:考查溶液中离子浓度的比较
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
A bad workman quarrels with his tools. 人笨怨刀钝。
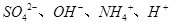 四种离子,则该溶液中的溶质可能是硫酸铵,则溶液呈酸性,c(NH4+)> c(SO42-)> c(H+)>c(OH-),正确,答案选D。
四种离子,则该溶液中的溶质可能是硫酸铵,则溶液呈酸性,c(NH4+)> c(SO42-)> c(H+)>c(OH-),正确,答案选D。