|
|
|
下列溶液中各微粒的浓度关系不正确的是A.0.1 mol·L-1的HCO【盐类水解的原理】
2016-12-25 17:05:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.等浓度、等体积的Na2CO3和NaHCO3混合: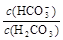 > >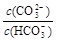
C.0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO 32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
|
选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.等浓度、等体积的Na2CO3和NaHCO3混合: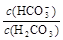 > >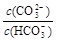
C.0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
|
本题答案:D
本题解析:
试题分析:A.0.1 mol·L-1的HCOOH溶液中根据电荷守恒可知c(HCOO-)+c(OH-)=c(H+),A正确;B.等浓度、等体积的Na2CO3和NaHCO3混合溶液中碳酸根的水解程度大于碳酸氢根的水解程度,则:
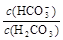
>
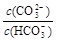
,B正确;C.0.1 mol·L-1的NaHCO3溶液中根据电荷守恒可知c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),C正确;D.等体积、等物质的量浓度的NaX和弱酸HX混合 后的溶液不一定显酸性,则c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)不一定正确,D错误,答案选D。
考点:考查溶液中微粒浓度关系判断
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
The man who saves when young will have more to spend when he is old. 年少节俭,年老不愁.
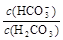 >
>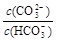 ,B正确;C.0.1 mol·L-1的NaHCO3溶液中根据电荷守恒可知c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),C正确;D.等体积、等物质的量浓度的NaX和弱酸HX混合 后的溶液不一定显酸性,则c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)不一定正确,D错误,答案选D。
,B正确;C.0.1 mol·L-1的NaHCO3溶液中根据电荷守恒可知c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),C正确;D.等体积、等物质的量浓度的NaX和弱酸HX混合 后的溶液不一定显酸性,则c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)不一定正确,D错误,答案选D。