|
|
|
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,【水的电离平衡】
2016-12-25 18:26:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液;
B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL;
| E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 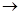 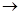 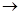 D D 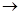 。 。
(2)操作E中的锥形瓶下垫一张白纸的作用是 。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是 。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是 &# 160; 。
实验题 某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液;
B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL;
|
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)
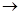
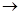
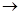
D
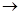
。
(2)操作E中的锥形瓶下垫一张白纸的作用是
。
(3)操作D中液面应调整到
。
(4)滴定终点的现象是
。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响?
(填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是
。
本题答案:(1):C;A;B;D;E;
(2)便于准确判断终点时
本题解析:
试题分析:(1)①实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,故答案为:C;A;B;D;E;
(2)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,故答案为:便于准确判断终点时颜色的变化情况;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,
(4) 指示剂为甲基橙,变色范围为 3.1~4.4,终点时pH约为4.4,颜色由黄色变为橙色,
故答案为:由黄色变为橙色;
(5) 因标准液浓度变小,用量变大,故答案为:偏高
(6) 硫酸的物质的量为c(V2-V1)×10-3mol,则n(NaOH)=2c(V2-V1)×10-3mol,m(NaOH)=80c(V2-V1)×10-3,则样品中NaOH的质量为10×80c(V2-V1)×10-3,
所以烧碱样品纯度为10×80×(V2-V1) ×10-3c/m×100%=80(V2-V1) c/m%(注意:V为mL),
考点:滴定操作及误差分析
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
A clean fast is better than a dirty breakfast. 宁为清贫,不为浊富。
 D
D  。
。
 D
D  。
。