微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 某温度(t ℃)时,水的离子积为K w=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是
______________________________________________________________。
(2)若所得混合溶液的pH=2,则a∶b=_____________。
计算题 某温度(t ℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是
______________________________________________________________。
(2)若所得混合溶液的pH=2,则a∶b=_____________。
本题答案:(1)10∶1(2分);c(Na+)>c(SO42-)
本题解析:
试题分析:由于该温度小水的离子积为Kw=1×10-13
所以此温度下pH=11的苛性钠溶液中c=(OH-)=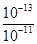 mol/L=0.01mol/L
mol/L=0.01mol/L
pH=1的稀硫酸中c(H+)=0.1mol/L
(1)若所得混合溶液为中性,这说明n(H+)=n(OH-)
因此bL×0.1mol/L=aL×0.01mol/L
解得a:b=10:1
由于所得溶液恰好是Na2SO4溶液,因此溶液中离 子浓度的大小关系是c(Na+)>c(SO42-)>c(H+)=c(OH-)
(2)若所得混合溶液的pH=2,这说明硫酸是过量的
因此有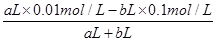 =0.01mol/L
=0.01mol/L
解得a∶b=9:2
考点:考查水的离子积常数、酸碱中和pH的计算
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
It is much more difficult to judge oneself than to judge others. 判断自己比判断别人要难得多