|
|
|
(10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定【水的电离平衡】
2016-12-25 19:09:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中定容成250 mL烧碱溶液;
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶 中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL;
| E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 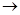 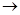 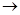 D D 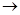 。 。
(2)操作D中液面应调整到 。
(3)滴定终点的现象是 。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是 。
实验题 (10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中定容成250 mL烧碱溶液;
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL;
|
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)
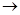
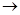
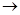
D
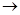
。
(2)操作D中液面应调整到
。
(3)滴定终点的现象是
。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响?
(填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是
。
本题答案:
(1)C;A;B;D;E;
(2)零刻度或零稍
本题解析:
试题分析:(1)正确操作步骤的顺序是C.称取品m g,溶解;配成成250 mL烧碱溶液;移取25 mL烧碱溶液,滴加指示剂;将标准H2SO4溶液装入滴定管,调整液面,记下开始刻度为;在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度。
(2)零刻度以上不能读数,操作D中液面应调整到零刻度或零稍下的某一刻度 。
(3)甲基橙作指示剂,用酸滴定碱,溶液从碱性滴定到终点,滴定终点的现象是由黄色变为橙色,且半分钟不变色 。
(4)若酸式滴定管没有用标准H2SO4润洗,标准H2SO4溶液被稀释,所用H2SO4溶液的体积会偏大,测定结果偏高。
(5)所用硫酸的体积为(V2-V1)/1000L,物质的量为cmol/L×(V2-V1)/1000L,所测氢氧化钠的物质的量为2cmol/L×(V2-V1)/1000L,烧碱样品中氢氧化钠的质量为[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml),该烧碱样品的纯度计算式是[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml)÷mg×100%= 80(V2-V1)c/m %。
考点:酸碱中和滴定的操作及计算
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Every bean hath its black. 每粒蚕豆都长黑嘴。 / 人都有缺点。
 D
D  。
。
 D
D  。
。