微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (每空2分,共10分)(1)常温时,将PH=13的强碱溶液与PH=2的强酸溶液混合,所得混合液PH=11,则混合时强碱与强酸溶液的体积比为__________。
(2)某温度下,纯水中的C(H+)="2.0×10" -7 mol?L-1, 则此时溶液的C(OH-)为___________________ mol?L-1;若温度不变,滴入稀盐酸使C(H+)=5.0×10-4mol?L-1,
则溶液中C(OH-)为_____________ mol?L-1, 由水电离产生的C(H+)为_____________ mol?L-1,此时温 度_________(填“高于”“低于”或“等于”)25℃.
填空题 (每空2分,共10分)(1)常温时,将PH=13的强碱溶液与PH=2的强酸溶液混 合,所得混合液PH=11,则混合时强碱与强酸溶液的体积比为__________。
(2)某温度下,纯水中的C(H+)="2.0×10" -7 mol?L-1, 则此时溶液的C(OH-)为___________________ mol?L-1;若温度不变,滴入稀盐酸使C(H+)=5.0×10-4mol?L-1,
则溶液中C(OH-)为_____________ mol?L-1, 由水电离产生的C(H+)为_____________ mol?L-1,此时温度_________(填“高于”“低于”或“等于”)25℃.
本题答案:20.(每空2分) (1) 1:9 &#
本题解析:
试题分析:(1)可根据溶液混合反应后剩余c(OH-)浓度列式求解。设以下标1表示酸,2表示碱。则混合前碱中c2(OH-)="0.1" mol·L-1,酸中c1(H+)="0.01" mol·L-1,则:c余(OH-)=10-3mol·L-1=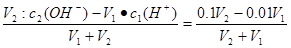 =0.001;解得V2∶V1=1∶9;
=0.001;解得V2∶V1=1∶9;
(2)纯水是显中性的,则c [H+]=c [OH-] =2.0×10-7mol/L,水的离子积Kw=[H+]·[OH-]=4.0x10-14, 若温度不变,滴入稀盐酸使C(H+)=5.0×10-4mol?L-1, 则溶液中C(OH-)为KW/[H+]="8.0×10" -11 mol?L-1; 由水电离产生的C(H+)为8.0×10 -11mol/L;因为温度升高,KW增大,所以此时温度高于25℃。
考点:考查pH的有关计算,水的电离等知识。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
Hsitory is bunk. 历史是一堆废话。