微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)以下是对化学反应变化过程及结果的研究。按要求回答问题:
(1)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) ?△H2=-29.1kJ·mol-1
乙醇异构化反应C2H5OH(g)=CH3OCH3(g))?△H3=+50.7kJ·mol-1
则乙烯气相直接水合反应
C2H4 (g)+H2O(g)=C2H5OH(g)的△H= 。
(2)在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)用一个离子方程式表示反应:100ml 3mol·L-1NaOH溶液中通入标准状况下4.48LCO2 ;所得溶液中离子浓度大小排列顺序为: ;
(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。下图是该燃料电池示意图,产生的X气体可直接排放到大气中。
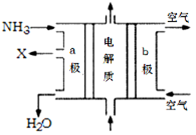
a电极电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 &# 160; ,请判断T 25℃(填“>”“<”“=”)。
填空题 (16分)以下是对化学反应变化过程及结果的研究。按要求回答问题:
(1)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) ?△H2=-29.1kJ·mol-1
乙醇异构化反应C2H5OH(g)=CH3OCH3(g))?△H3=+50.7kJ·mol-1
则乙烯气相直接水合反应
C2H4 (g)+H2O(g)=C2H5OH(g)的△H= 。
(2)在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)用一个离子方程式表示反应:100ml 3mol·L-1NaOH溶液中通入标准状况下4.48LCO2 & 91ExAm.org#160; ;所得溶液中离子浓度大小排列顺序为: ;
(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。下图是该燃料电池示意图,产生的X气体可直接排放到大气中。

a电极电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
本题答案:(1)-45.5 kJ·mol-1(3分)(2)>(1
本题解析:
试题分析:(1)已知:① 2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1,②2CH3OH(g)=C2H4 (g)+2H2O(g) ?△H2=-29.1kJ·mol-1,③C2H5OH(g)=CH3OCH3(g))?△H3=+50.7kJ·mol-1,则根据盖斯定律可知①—②—③即得到乙烯气相直接水合反应C2H4 (g)+H2O(g)=
C2H5OH(g) △H=-45.5 kJ·mol-1。
(2)pH=a的氢氧化钠溶液中氢氧根等浓度是10a—14mol/L,醋酸是弱酸,溶液中存在电离平衡,pH=b的醋酸溶液中醋酸的浓度大于10—bmol/L。在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则10a—14mol/L>10—bmol/L,所以a+b>14;二者恰好反应,则醋酸的浓度是10a—14mol/L,所以该温度下醋酸的电离常数K=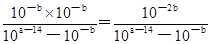 。
。
(3)氢氧化钠的物质的量是0.3mol,CO2是4.48L÷22.4L/mol=0.2mol,即氢氧化钠与CO2的物质的量之比是3:2,所以反应的离子方程式为3OH-+2CO2 =CO32-+HCO3-+H2O。由于碳酸根的水解程度大于碳酸氢根的水解程度,因此所得溶液中离子浓度大小排列顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)a电极通入的是氨气,氨气失去电子,发生氧化反应,则a电极是负极。又因为产生的X气体可直接排放到大气中,所以氧化产物应该是氮气,因此电极反应式为2NH3+6OH--6e- =N2+6H2O;根据铵根的水解平衡NH4++H2O NH3·H2O+H+可知水解平衡常数=
NH3·H2O+H+可知水解平衡常数=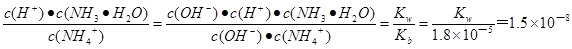 ,解得水的离子积常数Kw=2.7×10-13。常温下水的离子积常数是1.0×10-14,电离吸热,升高温度离子积常数增大,所以T大于25℃。
,解得水的离子积常数Kw=2.7×10-13。常温下水的离子积常数是1.0×10-14,电离吸热,升高温度离子积常数增大,所以T大于25℃。
考点:考查盖斯定律的应用、弱电解质的电离、盐类水解、离子浓度比较以及平衡常数的应用与计算
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
Sharp tools make good work. 工欲善其事,必先利其器.