|
|
|
室温时,将0.10 mol/L的NaOH溶液滴入20.0 mL未知浓度的某一元酸H【水的电离平衡】
2016-12-25 19:43:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 室温时,将0.10 mol/L的NaOH溶液滴入 20.0 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图。下列有关说法不正确的是
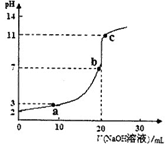
A.该一元酸溶液浓度为0.10mol/L
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka l×10-5 l×10-5
D.a点和c点所示溶液中H2O的电离程度相同
|
选择题 室温时,将0.10 mol/L的NaOH溶液滴入20.0 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图。下列有关说法不正确的是

A.该一元酸溶液浓度为0.10mol/L
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka l×10-5 l×10-5
D.a点和c点所示溶液中H2O的电离程度相同
|
本题答案:C
本题解析:
试题分析:A.NaOH、HA是一元碱、一元酸,当二者恰好完全反应时二者的物质的量相等,体积也相等,说明它们的浓度相等,该一元酸溶液浓度也相等,为0.10mol/L,正确;B.向弱酸溶液中加入强碱NaOH,发生中和反应产生盐,自由移动的离子浓度增大,溶液的导电性增强;当加入至酸完全反应时,自由移动离子进一步增多,离子浓度增大,溶液的导电性增强;后在加入N aOH,就相当与向盐NaA溶液中加入NaOH溶液。溶液中自由移动离子浓度增大,所以溶液的导电性比b点还强。故a、b、c点的水溶液导电性依次增强,正确;C.在未滴加NaOH溶液时,溶液的pH="2," c(H+)=10-2mol/L,NaOH是强碱,完全电离,当NaOH溶液滴入20ml时,恰好与酸HA完全反应,此时溶液的pH>7,说明得到的是强碱强弱酸盐,因此HA是弱酸,
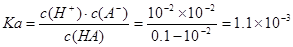
,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。
考点:考查电解质强弱的判断、物质浓度的计算及对水电离平衡的移动的影响的知识。
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
If you make a jest, you must take a jest. 爱开玩笑的人,也要经得住别人开玩笑.
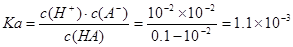 ,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。
,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。